Der pH-Wert (Wasserstoffionenkonzentration) - Erklärung und Beispiele
Wasser unter liegt in äußerst geringem Maße der elektrolytischen Dissoziation.
H2O --> H+ + OH-
beziehungsweise nach BRÖNSTED
H2O + H2O --> H3O+ + OH-
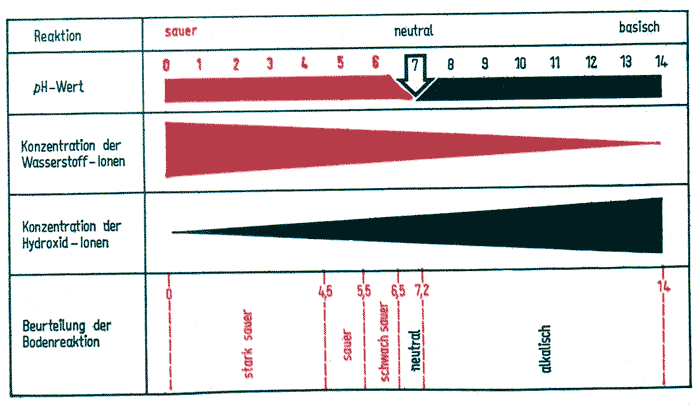
Die Wasserstoffionen H+ sind in wässriger Lösung nicht existenzfähig und werden sofort in Hydroniumionen H3O+ hydratisiert. Einfachheit halber wird dennoch von Wasserstoffionen gesprochen. In einem Liter Wasser bei 22ºC befinden sich 1 x 10-7 mol Wasserstoffionen und ebenso viele Hydroxidionen. In einer sauren Lösung ist die Wasserstoffionenkonzentration größer als 1 x 10-7 mol, ist sie kleiner, so ist die Lösung basisch, wie zum Beispiel bei den Baustoffen Kalk und Beton.
Der pH-Wert ist der negative dekadische Logarithmus des Zahlenwertes der molaren Wasserstoffionenkonzentration aH+ .
pH = -logaH ; aH = molare Wasserstoffionenaktivität.
Beispiele für pH-Werte wässriger Lösungen bei 25ºC (n = Normalität):
| n | ph-Wert | ||||||||
| HCl | H2S04 | HCOOH | CH3COOH | H2S | (H20) | NaHCO3 | NH3 | NaOH | |
| 1 | 0,1 | 0,3 | - | 2,4 | - | 7 | - | 11,6 | 14 |
| 0,1 | 1,1 | 1,2 | 2,3 | 2,9 | 4,1 | - | 8,4 | - | - |
Pufferung
Stabilisierung des pH-Wertes einer Lösung durch Zugabe eines Salzes, bei Säuren zum Beispiel eines Salzes aus einer schwachen Säure und einer starken Base, bei Basen durch Salze aus starken Säuren und schwachen Basen.
Neutralisierung
Bei der Neutralisierung werden Wasserstoffionen und Hydroxidionen zu undissoziiertem Wasser vereinigt. Dies findet zum Beispiel bei einer Salzsanierung von salzbelastetem Mauerwerk Anwendung. Da man aber nie genau die Quantität der vorhandenen Salze bestimmen kann, ist dieses Verfahren immer mit einer gewissen Unsicherheit verbunden. Nachfolgend eine einfache Reaktion
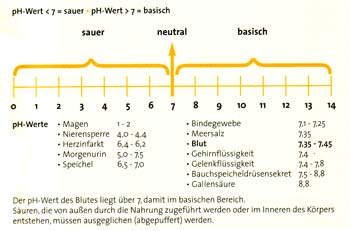
Der pH-Wert spielt auch im menschlichen Körper eine wichtige Rolle. Hier ist von großer Bedeutung das Säure-Basen-Gleichgewicht. Ist dieses Gleichgewicht gestört, so kommt es zur Erkrankung.
Quelle:
Schröder, Werner; Lautenschläger, K.-H.; Chemie, 17.Aul. VEB Fachbuchverlag Leipzig 1986, S.218f
Chemie in Übersichten, Volk und Wissen Volkseigener Verlag Berlin 1968, S. 37
© Altbausanierung | Bauideen | gesund Leben | Impressum | AGB/Datenschutzerklärung | 1/2019 ![]()
