Studiennummer: Ex. 7050/01
DK - Zahlen
Fachrichtung: Technologie der anorganischen und organischen Chemie
Bearbeiter: Peter Rauch
Abschlußarbeit, angefertigt auf Vorschlag
der AdW der DDR,
Institut für Biotechnologie
Angefertigt vom 8.6. bis 25.8.1987
Seitenzahl: 91
Abbildungen: 14
Literatur: 55
| Seite | ||
| Verzeichnis der Abkürzungen | 5 | |
| Vorwort und Aufgabenstellung | ||
| 1. | Theoretische Grundlagen zur Kalorimetrie | 10 |
| 1.1. | Thermodynamische Betrachtung | |
| 1.2. | Thermodynamik biologischer Systeme | 11 |
| 1.3. | Betrachtung der Wärmebilanz in einem Fermentorsystem | 13 |
| 2. | Kalorimetrische Meßmethoden | 16 |
| 2.1. | Methoden der kalorimetrischen Messung | |
| 2.2. | Kurzbeschreibung einiger kalorimetrischer Meßverfahren | 17 |
| 2.2.1. | Adiabatische Kalorimetrie | |
| 2.2.2. | Wärmefluß-Kalorimeter | |
| 2.2.3. | Differential-Kalorimetrie | 18 |
| 2.2.4. | Meßprinzip nach Differential-Thermoanalyse (DTA) | 19 |
| 2.3. | Direkte Messung der Wärmeentwicklung im mikrobiellen Stoffwechsel | |
| 2.3.1. | Mikrokalorimetrie | |
| 2.3.1.1. | Adiabatische Kalorimetrie in der Biotechnologie | 20 |
| 2.3.1.2. | Wärmeflußkalorimetrie in der Biotechnologie | |
| 2.3.1.3. | Strömungskalorimeter | 21 |
| 2.3.2. | Dynamische Kalorimetrie | |
| 2.3.3. | Kontinuierliche Kalorimetrie | 22 |
| 2.4. | Auswahl einer Methode zur kalorimetrischen Messung der biologischen Wärmeerzeugung im Fermentor | |
| 3. | Aufbau der Meßeinrichtung | 26 |
| 3.1. | Beschreibung der Meßwerterfassung | |
| 3.2. | Temperaturmessung | 27 |
| 3.2.1. | Theoretische Grundlagen | |
| 3.2.2. | Aufbau der Brückenschaltung | 29 |
| 3.2.3. | Andere Temperaturmeßverfahren | 31 |
| 4. | Automatisierte Meßwerterfassung der biologischen Wärmeerzeugung | 32 |
| 4.1. | Grundgedanken zur Meßwerterfassung und zum Einsatz von Rechentechnik in der Biotechnologie | 32 |
| 4.2. | Meßwerterfassung und -regelung der Fermentationstemperatur | |
| 5. | Fermentation | 34 |
| 5.1. | Allgemeines | |
| 5.2. | Das Laborfermentorsystem LPS 212 | 36 |
| 6. | Wachstumskinetik und Eigenschaften der Kultur Saccharomyces cerevisiae | |
| 6.1. | Wachstumskinetik | |
| 6.2. | Wärmebildungsrate | 38 |
| 6.3. | Eigenschaften der Kultur Saccharomyces cerevisiae | 40 |
| 6.3.1. | Vermehrung der Bäckerhefe | |
| 5.3.2. | Eigenschaften der Kultur bei der Kultivierung | 41 |
| 7. | Versuchsdurchführung | 42 |
| 7.1. | Aufgabenstellung | |
| 7.2. | Geräte für die Versuchsdurchführung | |
| 7.3. | Kurzbeschreibung des Versuchsaufbaus | 43 |
| 7.4. | Erprobung der Meßeinrichtung am LPS 212 | |
| 7.4.1. | Eichung und Aufbau eines Temperatur - Spannungsdiagrammes | |
| 7.4.2. | Bestimmung des Wärmestromes aus dem Fermentor | 45 |
| 7.4.2.1. | Aufgabenstellung | |
| 7.4.2.2. | Durchführung, Meßwerte und Berechnung | 46 |
| 7.4.2.3. | Bewertung des Teilversuches | |
| 7.4.3. | Erprobung der Temperaturdifferenzmessung des Kühlwassers | 48 |
| 7.4.3.1. | Aufgabenstellung | |
| 7.4.3.2. | Durchführung, Meßwerte und Berechnung | |
| 7.4.3.3. | Bewertung des Teilversuches | |
| 7.4.4. | Erprobung der Meßeinrichtung unter Verwendung eines Heizwiderstandes | 49 |
| 7.4.4.1. | Aufgabenstellung | |
| 7.4.4.2. | Durchführung, Messung und Berechnung | |
| 7.4.4.3. | Bewertung des Teilversuches | 51 |
| 7.4.5. | Erprobung der Meßkette mit größerem Heizwiderstand | 51 |
| 7.4.5.1. | Aufgabenstellung | |
| 7.4.5.2. | Durchführung, Messung und Berechnung | 52 |
| 7.4.5.3. | Bewertung des Teilversuches | |
| 7.4.6. | Erprobung der Temperaturdifferenzmessung bei konstantem Kühlwasserfluß über eine längere Zeit | 54 |
| 7.4.6.1. | Aufgabenstellung | |
| 7.4.6.2. | Durchführung, Messung und Berechnung | |
| 7.4.6.3. | Bewertung des Teilversuches | 55 |
| 7.5. | Auswertung der Versuchsdurchführung zur Erprobung der Meßeinrichtung am LPS 212 | |
| 7.6. | Weitere Betrachtung und Einschätzung über die Brauchbarkeit des Meßverfahrens | 57 |
| 7.6.1. | Allgemeines | |
| 7.6.2. | Trend des Signals unter Verwendung manipulierter Meßwerte | 58 |
| 8. | Zusammenfassung | 62 |
| Literaturverzeichnis | 69 | |
| Verzeichnis der Schemata | ||
| Verzeichnis der Bilder | ||
| Verzeichnis der Tabellen | ||
| Verzeichnis der Anlagen | 70 | |
| Selbstständigkeitserklärung |
| A | Fläche | m2 |
| a | Alter | |
| ATP | Adenosintriphosphat | |
| B | Konstante | |
| C | Wärmekapazität | J K-1 |
| CS | Strahlungskoeffizient | W m-2K-4 |
| cc | Heizrate des Kühlwassers | MJ kg-1 K-1 |
| cp | spez. Wärmekapazität bei konst. Druck | kJ kg-1K-1 |
| cp | Leistungsbeiwert | |
| C (dT/dt) | Aufheizleistung des Kalorimeters | MJ kg-1K-1 |
| d | Rührerdurchmesser, allgemein | m |
| FIR | Durchfluß, Anzeige, Registrierung | |
| Fc | Flußrate für Kühlwasser | m3h-1 |
| G° | freie Reaktionsenthalpie | J |
| H | Reaktionsenthalpie | J |
| Hc | Verbrennungswärme der Biomasse | kJ g-1 |
| Hs | Verbrennungswärme des Substrates | kJ g-1 |
| h | spezifische Enthalpie | kJ kg-1 |
| hw | Enthalpie des Wassers | kJ kg-1 |
| hM | Enthalpie der Mischung | kJ kg-1 |
| hG | Enthalpie des Gases | kJ kg-1 |
| I | Stromstärke | A |
| Kα | Konstante | |
| LIR | Füllstand, Anzeige, Registrierung | |
| mG | Massenstrom durch Gas | kg s-1 |
| mW | Massenstrom durch Wasser | kg s-1 |
| mGM | Massenstrom durch Mischung | kg s-1 |
| n | Drehzahl des Rührers | s-1 |
| P | Leistung | W |
| Pel | Elektrische Leistung | W |
| p | Druck | Pa |
| Q | Wärme | J |
| dQ/dt | Wärmefluß | J s-1 |
| Q | Wärmestrom | W |
| Qcon | Wärmeentfernung bei der Funktion von Stromreglung | MJ m-3 h-1 |
| QF | Wärmestrom aus dem System Fermentorinhalt | W |
| QG | Wärmestrom durch Begasung | W |
| Q'K | Wärmestrom, konvektiver Wärmeübergang | W |
| Q'KW | Wärmestrom durch Kühlwasser | W |
| Q'M | eingetragene Rührenergie | W |
| Q'N | Wärmestrom durch Nährlösung | W |
| Q'R | Reibungswärme durch Antriebsmotor | W |
| Q'S | Wärmestrahlung | W |
| Q'W | Wärmebildungsrate | W |
| Q'ZU | zugeführter Wärmestrom | W |
| q12 | zu- oder abgeführte Wärme | kJ kg-1 |
| R | Widerstand | Ω |
| R0 | Widerstand bei 0°C | Ω |
| Rθ | Widerstand bei Temperatur θ = Meßtemp. | Ω |
| S | Reaktionsentropie | J K-1 |
| T | absolute Temperatur | K |
| Tc | Temperatur des zugeführten Kühlwassers | K |
| TIR | Temperatur, Anzeige, Registrierung | |
| U | Spannung | V |
| UA | spez. Wärmeübertragungskoeff. für Kühlfläche | MJ m-3 h-1 K-1 |
| u | Eingangsgröße | |
| u | innere Energie | J kg-1 |
| V | Volumen | m3 |
| V' | Volumenstrom | m3h-1 |
| V | Spannung des eingetauchten Heizkörpers | V dc |
| v | Teilungsrate | h-1 |
| VL | liquidiertes Volumen | m3 |
| W'a | abgeführter Energiestrom | Ws |
| W'z | zugeführter Energiestrom | Ws |
| w12 | zu- oder abgeführte Volumenänderungsarbeit | J kg-1 |
| Wr | Reaktionsleistung | J s-1 |
| WS | Rührleistung | J s-1 |
| Wf | Wärmeflußleistung | J s-1 |
| x' | Abkühlungskonstante | s-1 |
| X | Biomassekonzentration | g l-1 |
| Y | Ertragskoeffizient | g J-1 |
| y | Ausgangsgröße | |
| z | Störgröße | |
| α | Temperaturkoeffizient (linear) | K-1 |
| αK | Wärmeübergangskoeffizient | W m-2 K-1 |
| β | Temperaturkoeffizient (quadratisch) | |
| Δθ | Temperaturänderung bezogen auf 273 K | K |
| ΔR | Widerstandsänderung bezogen auf 273 K | Ω |
| Δtwf | Temperaturgefälle zw. Flüssigkeit und Wand | K |
| ε12 | Emissionsverhältnis | |
| θ | Meßtemperatur | °C |
| μ | spez. Wachstumsrate | h-1 |
| ρ | Dichte | kg m-3 |
| ρc | Dichte des Wassers | kg m-3 |
Für die langfristige Sicherung eines stabilen Wirtschaftswachstums ist die Erhöhung des technologischen Niveaus der Produktion notwendig. Hierzu wurde auf dem XI. Parteitag der SED die verstärkte Entwicklung und Anwendung von Schlüsseltechnologien, wie z. B. der Biotechnologie, beschlossen. So ist die biotechnologische Produktion im Zeitraum von 1986 bis 1990 auf das 3-fache zu steigern. Dies ist nur auf der Grundlage der Konzentration des Forschungspotentials sowie durch die Beherrschung und Anwendung der modernen Arbeitstechniken der Biotechnologie in Verbindung mit neuesten Erkenntnissen der Verfahrens- und. Automatisierungstechnik zu realisieren. (/1/ 3.52)
Viele verschiedene biotechnologische Verfahren fanden in den letzten Jahren Anwendung. Dominierte noch vor Jahren Schwerpunktmäßig die Produktion von Single Gell Protein, so rücken die Gebiete der Herstellung von Diagnostika, Pharmaka, biologische Pflanzenschutzmittel, Gewinnung von Roh- und Werkstoffen u.a. immer mehr mit in den Vordergrund. In unserer Republik besteht sogar die Tendenz der verstärkten Produktion von kleintonnagigen hochwertigen Erzeugnissen.
Künftig wird die Biotechnologie breite volkswirtschaftliche Bereiche erfassen und die Leistungsfähigkeit der Wirtschaft eines Landes wird auch auf diesem Gebiet gemessen.
Viele neu entwickelte biotechnologische Verfahren stellen hohe und höchste Anforderung an die Prozeßführung und -überwachung. Bisher konnten bereits teilautomatisierte Anlagen produktiv wirksam werden. Es treten jedoch noch viele ungelöste Probleme auf, weil einige Prozeßwerte ungenau oder gar nicht erfaßt werden können. Hinzu kommen Meßmethoden, die für eine Automatisierung noch nicht ausgereift sind. Eine Übertragung aus dem Labormaßstab auf eine Produktionsanlage ist in vielen Fällen nur bedingt möglich, so daß z. B. erst viel zu spät auf Veränderungen in der Biologie reagiert werden kann. Dies hat natürlich zur Folge, daß z. B. geringe Konzentrationen bei, der Enzymherstellung, ungewollte Schleimbildung bei bestimmten Bakterienkulturen durch ungünstige Mikrobereiche, bis hin zu geringen Ausbeutegraden (Verhältnis Biomasse zu Substrat) erzieht werden.
Neben der Entwicklung neuer Verfahren und der Züchtung leistungsstarker Kulturen ist der Einfluß des Nährmediums, der Inoculummenge und des physiologischen Zustandes der Zelle im Inoculum, der Betriebsparameter wie pH-Wert, Sauerstoff- und C02-Partialdruck in der Flüssigkeit sowie der Einfluß von Scherkräften, die aus der Art und Intensität der Belüftung resultieren, für die Optimierung zu beachten. (/2/ S.379)
Eine wichtige Voraussetzung für eine optimale biologische Prozeßführung ist die genaue Erfassung und Verarbeitung der Prozeßparameter und aller erkennbaren Einflußgrößen. Neben dem Redoxsignal kann die kontinuierliche Erfassung der Wärmebildung durch die Mikroorganismen wesentlichen Aufschluß auf den Prozeßverlauf geben. Durch richtige Auswertung des Biosignals kann z. B. eine Unsterilität zeitiger erkannt werden oder der maximale Nutzeffekt bei der totalen Oxidation des Substrates und damit hohe Ausbeutegrade erreicht werden.
Zur Messung der Wärmeentwicklung bei Mikroorganismen finden seit langer Zeit kalorimetrische Messungen Anwendung.
In der vorliegenden Arbeit wurden verschiedene Untersuchungsmethoden durch die Kalorimetrie betrachtet und eine geeignete Methode ausgewählt. Dabei steht das Ziel, keine absoluten Werte für die Wärmeerzeugung durch Mikroorganismen zu messen, sondern ein einfaches, für die Praxis anwendbares, Meßverfahren auszuwählen, welches eine klare Aussage über die Änderung des physiologischen Zustandes der Kultur gibt. Die Funktionsfähigkeit soll in einem Fermentor K 1520 - Steuerungssystem mit der Hefekultur Saccharomyces cerevisiae nachgewiesen werden.
Durch gezielte Beeinflussung des Wachstumsprozesses ist das zu erzielende Biosignal einzuordnen und als Meßgröße bzw. für die Überwachung des Fermentationsprozesses zu nutzen.
Die thermodynamische Betrachtung kann aus verschiedenen Gesichtspunkten erfolgen. Die gesamte Darstellung geht über das Ziel dieser Arbeit hinaus. Es werden daher nur wichtige Aspekte erwähnt. Auf die Herleitung sowie einzelne Zusammenhänge, wird weitestgehend verzichtet.
Grundlage der thermodynamischen Betrachtung ist der 1. Hauptsatz, der wie folgt lautet:
Die Änderung der inneren Energie ist gleich der Summe der dem System in Form von Arbeit und Wärme zugeführten oder abgeführten Energie
q12+ wl2= u2- u1 (1)
mit w12= - 21∫pdv (2) (/3/ S. 15)
Die Gleichung wird auf ruhende geschlossene thermodynamische Systeme angewendet, z. B. im wärmeisolierten Gefäß als adiabatischer Prozeß.
Die innere Energie ist eine kalorische Zustandsgröße. Sie stellt einen Ausdruck für kinetische und potentielle Energie der im thermodynamischen System enthaltenen Teilchen dar und beschreibt damit den Energieinhalt eines Systems.
Theoretisch kann der Arbeitsprozeß entweder reversibel oder irreversibel durchgeführt werden. /4/
Die innere Energie ist eine Zustandsgröße, so wie es im 1. Hauptsatz definiert wird. Demgegenüber sind der Wärmeeffekt der Reaktion und die Menge der geleisteten Arbeit bei verschiedenen Durchführungsarten der Reaktion von Fall zu Fall verschieden (/5/ S. 273), was auch in den verschiedenen kalorimetrischen Meßmethoden Anwendung findet.
In der Biologie worden die Fermentationsprozesse in offenen Reaktionsbehältern durchgeführt, so daß eine Volumenänderung zugelassen ist. Der Druck gleicht sich mit dem atmosphärischen Luftdruck aus und der Prozeß verläuft demnach bei konstantem Druck.
Es handelt sich hierbei um einen isobaren Prozeß, bei welchem die Wärme gleich der Änderung der Enthalpie ist. (/6/ S. 178) Bei kleinen Temperaturintervallen ist cp in Näherung konstant und man erhält
h2- h1 = cp(T2- T1)(3) (/7/ S. 41)
Bei isobaren Prozessen führt demnach die vom System aus der Umgebung aufgenommene Wärme ausschließlich zu einer Änderung der Enthalpie. /8/
Die Werte cpund cv unterscheiden sich kaum, so daß die o.g. Gleichung auch für flüssige Körper gilt.
Untersucht man mit Hilfe der Kalorimetrie die Vorgänge. beim Wachstum von Organismen - hier speziell von einzelligen Lebewesen - in einem Fermentationssystem, so muß man davon ausgehen, daß stets nur integrale Aussagen gewonnen werden können, da eine Vielzahl von einzelnen Zellen und in ihnen verschiedene Prozesse zu der beobachteten Wärmetönung beitragen /9/.
Bei der Anwendung thermodynamischer Überlegungen auf das Geschehen im lebendigen Organismus müssen einige Besonderheiten beachtet werden:
Die Gültigkeit des I. Hauptsatzes und des HESSschen Gesetzes kann z. B. durch Vergleich der kalorimetrisch gemessenen Verbrennungswärme der Nährstoffe mit der Wärme nachgewiesen werden, die bei der biologischen Oxidation freigesetzt wird. Die Oxidation verläuft in komplizierten Reaktionsketten, d. h. stufenweise in einer Reihe von Teilreaktionen.
Wie bereits erwähnt ist das biologische System offen und es muß bei der Beurteilung der Änderung seiner Entropie ΔS sowohl die innerhalb des Systems eingetretene Änderung ΔvS, als auch die durch die Kommunikation mit der Umwelt hervorgerufenen Änderung, ΔtS, in Betracht gezogen werden, so daß
ΔS = ΔvS + ΔtS (4)
geschrieben werden kann. Im Organismus werden durch spontane, d. h. irreversible Vorgänge Substanzen mit einem hohen Grad Ordnung, d. h. mit niedriger Entropie (Nährstoffe) zu einfachen Verbindungen mit hoher Entropie (C02, H20 usw.) abgebaut. Der Kontakt mit der Umgebung macht den Übergang von Entropie aus dem Lebewesen oder umgekehrt möglich.
Auf der Grundlage der Berechnung der freien Reaktionsenthalpie
ΔG = ΔH - T ΔS (5)
wird die freie Enthalpie eine additive Größe mit der z. B. die biochemische Oxidation demonstriert werden kann. Für die Änderung der freien Enthalpie erhält man einen Wert, deren Aussage allerdings dadurch beschränkt ist, daß sie auf einem für ein abgeschlossenes, sich im Gleichgewicht befindliches System geltenden Funktionswert basiert. Was in einem solchen System gilt, kann auf den lebenden Organismus nicht einfach übertragen werden.
Der II. Hauptsatz der Thermodynamik findet auch hier Anwendung, da irreversible Vorgänge vorliegen und es den Organismen nicht möglich ist den Energieinhalt des Substrates völlig - ohne Wärmeverlust - als Arbeit auszunutzen. Die Verwertung der freien Enthalpie, die bei katabolitischen Prozessen freigesetzt wird, kann nicht l00%ig wirksam werden. Es kann daher zwischen einer katabolitischen Reaktion freisetzbaren freier Enthalpie und der biologischen nützlichen Energie unterschieden werden. (/5/ S. 311... 315)
Im Punkt 6. erfolgen zur Wärmeproduktion durch Mikroorganismen weitere Ausführungen.
In diesem Punkt sollen weitestgehend alle Faktoren, die in einem biologischen Fermentationsprozeß auftreten, genannt werden. Es wird von der Annahme ausgegangen, daß die kalorimetrische Messung im Reaktionsbehälter erfolgt. Es müssen somit folgende Wärmeströme berücksichtigt werden:
1. Wärmestrom durch den Rührer QM
Die eingetragene Leistung durch den Rührer lautet
P = cPα n3d5 (6)
Wobei der Leistungsbeiwert von der Reynolds-Zahl abhängig ist. (/10/ S. 176) Mit der Kenntnis der Leistungskennwerte des Antriebsmotor kann die eingetragene Leistung bestimmt werden,
Die Wirkleistung errechnet sich aus
Pw = U I • cosφ (7) (/11/ S. 260).
2. Reibungswärme durch den Antriebsmotor QR
Der Antriebsmotor erwärmt sich bei der Umwandlung von elektrischer in mechanische Energie. Diese Wärme wird über die Antriebswelle dem Medium zugeführt. Gleichzeitig treten Reibearbeiten an den Dichtringen und im Lager auf.
3. Wärmestrom durch die Nährlösung QN
Zur Aufrechterhaltung der Biologie muß ständig Nährlösung, Lauge oder Säure zugeführt werden. Die einzelnen Substanzen müssen zu einer Summe (Wärmeströme) addiert werden. Für Flüssigkeit gilt:
Q =φ v c (T1- T0) (8)
4. Wärmestrom durch die Begasung QG
Die Luft stellt ein Gas-Dampf-Gemisch dar, welches in die Flüssigkeit eingeblasen wird. Die absolute Feuchtigkeit erhöht sich. Dabei wird Flüssigkeit verdampft. Die Verdampfungswärme wird aus der Fermentorflüssigkeit geliefert, welche sich abkühlt. Die Enthalpiebilanz bei der Zumischung lautet:
mghg+ mwhw= mgmhm (9)
Hut das Gasgemisch eine niedrigere Temperatur als die Fermentorbrühe, so gleicht sich die Temperatur des durchströmenden Gases an und der Flüssigkeit wird Wärme entzogen, bis sich das thermodynamische Gleichgewicht einstellt. (/10/ S. 273...284, /7/ S. 188...199)
Es ist weiterhin das Gleichgewicht zwischen dem System Sacharoselösung und Wasserdampf zu beachten. Wobei der Dampfdruck über der Sacharoselösung kleiner als bei Wasser ist. (/12/ S. 87)
5. Konvektiver Wärmeübergang und Wärmestrahlung QK und QS
An der Oberfläche des Fermentorsystems entsteht ein Wärmeübergang. Die Berechnung nach NEWTON lautet:
QK= αKA Δtwf (10)
Von außen erfolgt eine freie Luftströmung, von innen hat die Flüssigkeit eine erzwungene Strömung, wobei hier der Wärmeübergangskoeffizient sehr groß ist. Der durch die Strahlung übertragene Wärmestrom wird durch die Gleichung
QS= A εl2 CS (T4)4/100 - (T2)4 /100 (11)
dargestellt. (/7/ S. 217...259)
Die übertragene Wärme wird durch die Form, Größe und Entfernung der umliegenden Körper bestimmt.
6. Wärmestrom durch das Kühlwasser QKW
Der Fermentationsprozeß muß bei einer bestimmten Temperatur gefahren werden, um die optimalen Wachstumsbedingungen einzuhalten. Die überschüssige Wärme wird durch ein Kühlsystem abgeführt. Für die Berechnung des Wärmestroms kommt die Gleichung 8 zur Anwendung.
7. Wärmeerzeugung bei Zellwachstum
Die Wärmebildungsrate kann rechnerisch und experimentell durch Kultivierung bestimmt werden. Im Punkt 6.2. wird dies ausführlich dargestellt.
Für ein biologisches System sind alle Energieströme zu erfassen, die die Bilanzhülle schneiden(Enthalpie, Wärme, mechanische Leistung, kinetische und potentielle Energie) und es gilt allgemein:
Summe aller zugeführten = Summe aller abgeführten
Energieströme Energieströme
∑ Wz = ∑ Wa (12) (/7/ S. 51)
Bei einem biologischen Wachstumsprozeß in einem Fermentor treten im wesentlichen die o.g. Energieströme auf, die ständig einer Größenordnung unterliegen, so daß von keiner konstanten Bedingung ausgegangen werden kann. In einer stark vereinfachten Bilanzgleichung sollen alle Energieströme dargestellt werden.
Qw- QKW- QK- QS- QG - QN + QR + QM = 0 (13)
Es wird damit deutlich, daß eine kalorimetrische Messung der Wärmetönung äußerst kompliziert ist. Auch wenn. viele Einflußfaktoren ausgeschaltet werden, wie es bei der adiabatischen Kalorimetrie versucht wird, ist jede Versuchsdurchführung sehr schwierig und mit einem hohen gerätetechnischen Aufwand verbunden.
Die Messung der Wärmebildung durch die Mikroorganismen kann nach zwei Grundgedanken erfolgen:
1. Die beeinflussenden Energieströme sind auszuschließen mit dem Kompromiß, eines großen gerätetechnischen Aufwandes und einer möglichen Beeinflussung der Biologie z. B. aerobe Kulturen im Kalorimetergefäß (Mikrokalorimetrie).
2. Es wird ein Signal erfaßt, wo jedoch die Summe der Störsignale wesentlich kleiner als das zu messende Nutzsignal sein muß. Dazu ist eine Größenbestimmung der einflußnehmenden Energieströme erforderlich.
Bei der 1. Methode ist eine absolute Wärmetönung meßbar, wohingegen man bei der 2. Methode nur einen relativen Wert erhält. Je nach Art der Durchführung sind diese Meßgrößen unterschiedlich genau. Sie können aber Aufschluß über den Zustand der Kultur (log oder stationäre Phase) geben.
Für die Durchführung der kalorimetrischen Messung finden in der Praxis folgende Methoden Anwendung:
1. Adiabatische Kalorimetrie
Das Kalorimetergefäß wird durch einen “adiabatischen Mantel“ umschlossen. Dessen Beheizung ist so geregelt, daß die Temperaturdifferenz während der Meßdauer kleiner als die Regelgenauigkeit ist. Die Wärmeentwicklung in der Probe führt zu einem Temperaturanstieg ΔT = ΔTad, aus dem man nach
Q = c ΔT (14)
die Wärmemenge berechnen kann.
2. Anisotherme Kalorimetrie
Ein Teil der von der Probe entwickelten Wärme führt zu einem Temperaturanstieg ΔT, ein nicht zu vernachlässigender Teil fließt an die Umgebung (=Thermostat) ab. Man berechnet die wahrend der Messung abgeflossene Wärmemenge nach
dQ/dt = x c(T — r0) (15)
und ermittelt so den Temperaturanstieg Tad, der sich unter adiabatischen Versuchsbedingungen ergeben hätte.
3. Isotherme Kalorimetrie
Zur Aufrechterhaltung von (genähert) isothermen Bedingungen während einer kalorimetrischen Messung gibt es zwei Möglichkeiten; die kompensatorische Arbeitsweise oder die Arbeit bei großem Wärmefluß. Da beide Arbeitsweisen ein Wärmefluß benötigen, lassen sich Temperaturdifferenzen nicht vermeiden. Kur in gut gerührten Flüssigkeiten kann man isotherme Versuchsbedingungen mit befriedigender Näherung realisieren.
In neuer Zeit haben themisch-kalorische Meßverfahren Verbreitung gefunden, bei denen man die Probe und eine Vergleichssubstanz als Standard in zwei Bohrungen eines gemeinsamen Heizblocks unterbringt und diesen über einen größeren Temperaturintervall linear aufheizt. Dieses Verfahren wird als Differential-Thermoanalyse (DTA) bezeichnet.(/13/ S. 780)
Die sogenannte adiabatische Methode besteht darin, das Kalorimetergefäß in einen beheizbaren „adiabatischen Mantel“ einzubauen und dessen Temperatur so zu regeln, daß während der Dauer des zu untersuchenden Prozesses um weniger als eine durch die Regelbreite vorgegebene Schranke (z. B. l0-3K) von der Kalorimetertemperatur abweicht. Dann bleibt der Wärmefluß verschwindend klein und die im Kalorimetergefäß gemessene Größe ΔT kann unmittelbar in die Gleichung 10 eingesetzt werden. Als Temperaturfühler für die Regelung der Mantelheizung dienen Thermoelemente, die zwischen Mantel und. Kalorimeter angebracht werden. Bevorzugtes Anwendungsgebiet sind CP-Messungen nach der Aufheizmethode bei tiefen und bei hohen Temperaturen. Der dabei resultierende, genäherte lineare Temperaturanstieg des Kalorimetergefäßes mit der Probe läßt sich regeltechnisch unschwer durch die Mantelheizung reproduzieren. (/13/ S. 783)
Bei dem Wärmefluß-Kalorimeter wird die vom Kalorimeter an den umgebenden Thermostaten bzw. an eine Wärmesenke abgeführte Wärmeleistung als Funktion der Zeit gemessen. Die Möglichkeit, diesen Wärmefluß nach dem NEWTONschen Abkühlungsgesetz (Gleichung 15) mit einer einzigen Abkühlungskonstanten x zu beschreiben, setzt voraus, daß die Innenfläche des Thermostaten eine gleichförmige und konstante Temperatur aufweist und auch auf der gesamten Oberfläche des Kalorimetergefäßes während der ganzen Meßdauer die gleiche Temperatur herrscht. Unter diesen Voraussetzungen gilt
Wf= x C ΔT = λ ΔT
Meßsignal ist auch hier die Größe ΔT = f(t). Sofern die Temperatur innerhalb des Kalorimetergefäßes stets gleichförmig verteilt ist und mit der Temperatur seiner Oberfläche praktisch übereinstimmt (gut gerührte Flüssigkeit, dünnwandiges Silberblech), eignet sich die Wärmefluß-Kalorimetrie für reaktionskinetische Messungen.
Man benutzt für die Auswertung die (vereinfachte) Wärmebilanzgleichung
Wr+ Ws= Wf+ C(dT/dt) (16)
deren linke Seite die wärmeerzeugenden Größen enthält, während auf der rechten Seite die Wärme verbrauchenden Größen stehen, die sämtlich Funktionen von t sind. Je größer der Wärmefluß ist, um so schnellere Prozesse können kalorimetrisch erfaßt und verfolgt werden. Andererseits nimmt jedoch die Signalhöhe ΔT für eine gegebene Reaktionsleistung Wr etwa umgekehrt proportional zur Abkühlungskonstanten x ab, so daß die von der Unruhe des Meßsignals herrührende Meßunsicherheit wächst. Der erforderliche definierte Wärmefluß läßt sich mit Hilfe eines konstant temperierten Wärmetauschers oder einer Wärmepumpe erzeugen. (/13/ S. 785)
Es enthält zwei gleichartig gebaute Kalorimetergefäße in dem selben Thermostaten. In dem einen Gefäß läuft die zu untersuchende Reaktion ab, während das andere mit einer inerten Vergleichssubstanz von möglichst identischer Wärmekapazität gefüllt ist und als Bezugspunkt für die differentielle Temperaturmessung zwischen den beiden Gefäßen dient. Hauptvorteil dieser Bauweise ist, daß sich Kurzzeit- und Langzeitschwankungen der Thermostaten-Temperatur auf beide Gefäße in nahezu gleicher Weise auswirken und deshalb das differentielle Meßsignal nur sehr wenig beeinflussen. Es läßt sich also die Unruhe des Meßsignals auf einen Wert herabdrücken, der erheblich kleiner als die Regelgenauigkeit des Thermostaten ist, so daß Messungen mit einer Auflösung bis l0-6K ausgeführt werden können. Man wendet deshalb die Differential-Kalorimetrie bevorzugt auf mikrokalorimetrische Messungen an, oder aber für Langzeitmessungen, bei denen ebenfalls nur sehr kleine thermische Leistungen auftreten (Auflösung ca. l μW).
Ferner läßt sich in einem Differential-Kalorimeter bei kompensatorische Arbeitsweise ein direkter Vergleich z. B. zwischen chemischer Reaktionswärme und elektrischer Energie durchführen. Ein exothermer Prozeß wird durch geregelte Beheizung des zweiten Gefäßes derart kompensiert, daß die Temperaturdifferenz zwischen beiden Gefäßen stets unter einer durch die Regelgenauigkeit gegebenen Schranke bleibt; dieses Verfahren arbeitet anisotherm. Einen endothermen Prozeß kann man durch geregelte Beheizung des gleichen Gefäßes kompensieren (isotherme Kalorimetrie). (/13/ S. 784)
Es unterscheidet sich von der Kalorimetrie dadurch, daß die Temperaturmessung in einen energetisch offenen System erfolgt und deshalb für eine thermodynamische Auswertung wenig geeignet ist. Der unter den Versuchsbedingungen registrierte Temperaturverlauf ist ein Mittel zur Charakterisierung des Reaktionsablaufes. (/13/ S. 792) Mit diesem Meßprinzip lassen sich thermodynamische und kinetische Reaktionsparameter bestimmen. /11/
Nach dem in den vorangehenden Punkten 2.1. und 2.2. die kalorimetrischen Meßmethoden dargestellt werden, sollen hier die in der technischen Mikrobiologie angewendeten Verfahren beschrieben werden.
Aus der Literatur geht hervor, daß bereits seit langer Zeit die Wärmebildung durch Mikroorganismen in Kalorimeter mit Wärmemantel und anderer Technik gemessen werden. /15, 16, 17/ Bei den meisten Reaktionsgefäßen ist ein hoher technischer Aufwand erforderlich, da die Apparatur zur Bestimmung der Wärmeentwicklung beim Wachstum und der Produktbildung relativ kompliziert ist. (/l8/ S. 7)
In der Literatur werden recht zahlreiche Kalorimeter beschrieben.
Das Prinzip wird je nach Zweck, Funktion und Reaktionswirkung im Medium bestimmt. /19/ Vorteile der Mikrokalorimetrie ist die Messung kleiner Wärmeänderungen bei geringer Substanzmenge. Oft findet die Methode der Messung im Zwillingskalorimetersystem Anwendung. Die Anzeige kann für eine längere Betriebszeit erfolgen, wobei das Wirkgefäß vom Bioreaktor getrennt ist. Hier gibt es aber Schwierigkeiten bei der Messung bei aeroben Kulturen. Nachfolgend werden einige Methoden der Mikrokalorimetrie aufgeführt. (/18/ S. 8)
Im Punkt 2.2.1. wird diese Methode beschrieben. Die absolute Empfindlichkeit des adiabatischen Kalorimeters liegt nach Berichten bei 2,1 J h-1 und die Messung erfolgt bei einer gewöhnlichen Ausführung und einem Flüssigkeitsvolumen von 250 cm3./20/ Die Probe wird in einem gesonderten Reaktionsbehälter während des Fermentationsbetriebes gemessen. Diese Meßmethode ist auf Experimente im Batchbetrieb begrenzt. Es werden auch Untersuchungen an mikrobiellen Systemen mit Hilfe von adiabatischen Zwillingskalorimetern durch. (/18/ S. 8)
Unähnlich dem adiabatischen Kalorimeter, bei dem der Reaktionsbehälter isoliert ist, gestattet die Wärmeflußkalorimetrie nur die Kontrolle der Wärmeänderung. Die Wärmeströmungsrate wird als Temperaturänderung mit einer bestimmten Vorgabe auf einer Anzeige aufgeführt. Als Meßelemente werden Multiberührungsthermoelemente verwendet. Der Wärmedurchgang ist zugleich eine direkte Kontrollmöglichkeit des Wärmedurchganges. Es steht dabei der Wärmeübergang mit der Aufrechterhaltung der Temperaturdifferenz in Verbindung. Der Wärmeübergang erfolgt in einer Reihe von Wärmetauschern, dabei ist die Größe des Temperaturniveaus abhängig von der Größe der durchdringenden Strömung. Wie bei dem adiabatischen Kalorimeter, das als Zwillingskalorimeter aufgebaut ist, werden Meßelemente in den Reaktionsbehälter und in einem Vergleichsbehälter eingesetzt. Die Arbeitsweise und der Aufbau des Wärmeströmungsmessers sowie seine Entwicklung ist umfangreich beschrieben. /21, 22, 23, 24/ Die absolute Empfindlichkeit des Wärmeströmungsmessers, er arbeitet mit einer Probe von 10 cm3, ist höher als die von dem adiabatischen Kalorimeter. Es können fast 0,042 J h-1 ohne Mühe nachgewiesen werden. Diese Meßmethode dient mikrobiologischen Studien./20/ Die Instrumente sind robust und finden umfangreiche Verwendung in der mikrobiologischen Arbeit. Seine Verwendung ist jedoch auf Experimente in Batchkulturen begrenzt. (/l8/ S. 9)
Recebthy, Erikson und Wadso /25/sowie Erikson und Holme /26/ beschreiben ein Strömungskalorimeter, welches zur Messung der Wärmeentwicklung angewendet werden kann, auch wenn Störungen durch Gas, Alkali oder Nährstoffe auftreten. Die kalorimetrische Zelle ist mit dem äußeren Reaktionsbehälter mit veränderlichem Volumen über einen Pumpenfluß gekoppelt. Die Wärmeerzeugung im Reaktionsbehälter durchdringt direkt die thermophile Umgebung der Meßzelle, erzeugt ein elektrisches Potential, welches später verstärkt als Wärmeflußrate aufgezeichnet wird.
Dieses Gerät ist ausschließlich für die Anwendung der Züchtung von anaeroben Kulturen im kontinuierlichen System entwickelt worden. Wegen des Sauerstoffmangels ist diene Methode für aerobe Batchkulturen nicht anwendbar.
Diese Kalorimetrie ist brauchbar für die Erkennung kleiner Wärmeänderungen und hat eine hohe Empfindlichkeit. Mit dieser Methode ist auch die Wachstumsstudie in kontinuierlichen Kultursystemen möglich. (/l8/ S. 10)
Ein Erfolgsversuch, welcher von Cooney u.a. /27/ berichtet wird, beruht auf einer einfachen Technik für die Messung der Wärmeproduktion während eines mikrobiologischen Prozesses durch die Überwachung der Flüssigkeitstemperatur beim Wachstum. Durch eine Temperaturkontrolle wird die Abweichung angezeigt. Ein empfindlicher Thermistor ermöglicht die Aufzeichnung der Temperaturkurve als Funktion von der Zeit. Die Arbeitsgenauigkeit der dynamischen Kalorimetertechnik liegt dem Bericht nach bei 1,2%. Dabei ist die Menge der Wärmeabgabe ungefähr 20 MJm-3h-1. Die relative Einfachheit der Anwendung der dynamischen Kalorimetertechnik ist ein Vorteil. Die Anfahrt verlangt wie auch immer eine ständige Aufmerksamkeit während des Experimentes und kann daher nicht für die automatische Prozeßkontrolle verwendet werden. Des Weiteren wirkt sich die Messung (Temperaturdifferenz) störend auf die mikrobiologische Aktivität aus. (/18/ S. 10)
Die kontinuierliche Kalorimetrie verwendet ein spezielles Temperaturkontrollsystem für die kontinuierliche Messung der Wärmeentwicklung während eines mikrobiologischen Prozesses. /28/ Es erfolgt eine konstante Wasserkühlung. Der Temperaturunterschied wird im Bioreaktor durch eine elektrische Eintauchheizung beseitigt. Die Messung der Temperatur der Fermentationsbrühe erfolgt durch eine Temperaturkopplung im Vergleich zu einer Bezugstemperatur und ihrer elektrisch proportionalen Anzeige. Die Differenz zwischen den Signalen ist das Prinzip der Kontrolle der programmierten direkten Stromversorgung. Der Wärmeunterschied im Bioreaktor kann bei Schätzungen als die Differenz zwischen der Wärmeübertragung von der Fermentationsbrühe zu dem Kühlwasser und der Wärmeproduktion durch die Eintauchheizung gewertet werden. Mathematisch kann der Wärmeunterschied wie folgt Ausgedrückt werden:
Qcon = UA KαFc VL(KαKc+1) x (T – Tc) - VI / VL (17)
wobei K = 2 Cc ρC/ UA (18).
Die Arbeitsgenauigkeit der kontinuierlichen Kalorimetrie liegt bei 2,04 +1,31%. Wird diese Technik mit der dynamischen Kalorimetrie verglichen, so besitzt sie einen experimentellen Vorteil. Bei beiden Techniken ist das Wärmegleichgewicht durch Rührleistung, Belüftungsrate, Bildungswärme, Wärmeverlust usw. zu berücksichtigen. (/l8/ S. l2)
Vor dem Literaturstudium wurden eigene Gedanken zur Messung der Wärmetönung entwickelt. Im Vordergrund stand die Idee der direkten Messung mit einem Meßfühler, wie es mit der pO2- oder pH-Elektrode erfolgt. Eine denkbare Lösung hierzu wurde in der Literatur gefunden. Eine Erläuterung erfolgt in der Zusammenfassung.
Es wurden folgende Gedanken entwickelt:
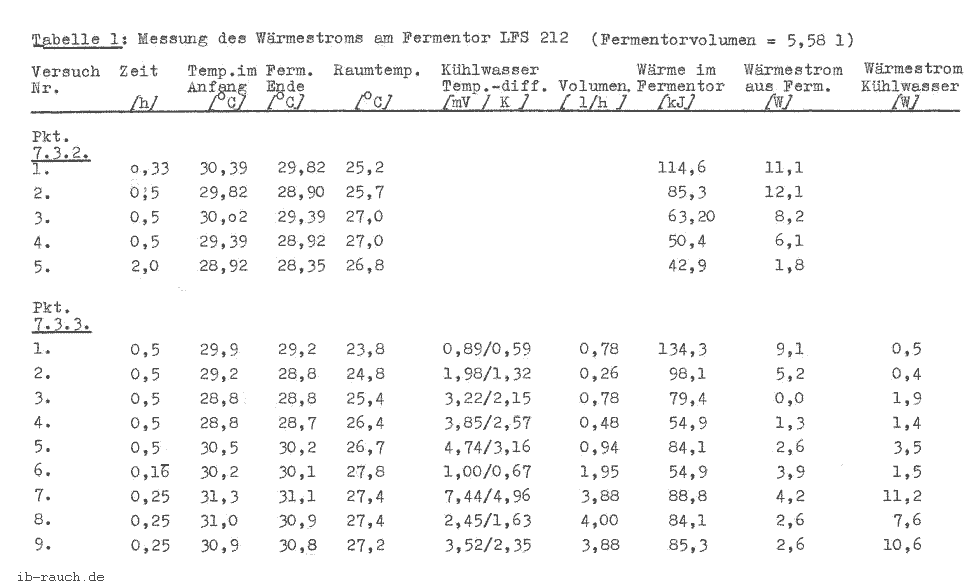
Ausgehend von diesen Gedanken wurde gleichzeitig eine labortechnische Lösung der Messung der Wärmetönung entwickelt. Im Schema 1 wird dies skizziert. Es ist ersichtlich, daß die im Punkt 1.3. festgestellten Komplikationen zur Erfassung aller Einflüsse nur durch einen sehr hohen technischen Aufwand zu lösen sind. Aus der Literatur geht hervor, daß viele Versuche unternommen wurden, eine günstige für die Praxis anwendbare Methode zu entwickeln. Aus der Sicht, daß die Kontrollmöglichkeit in einer Großanlage Anwendung finden soll, ist von folgenden Anforderungen auszugehen:
Die in der Praxis bereits erprobten Verfahren sind zum Teil anwendbar. Am günstigsten scheint dabei die kontinuierliche Kalorimetrie zu. sein. Im Punkt 4.2. wird eine Methode als Zweipunktregelung unter dem Gesichtspunkt der Prozeßregelung aufgeführt, hier kann die genannte Kalorimetrie Anwendung finden. Eine kontinuierliche Kühlung kann bei einem Laborverfahren angewendet werden. Bei einer großtechnischen Anlage ist dies aus ökonomischer Sicht nicht vertretbar. In bedingten Fällen wäre die Anwendung eines geschlossenen Kühlmittelsystems durchaus denkbar.
Schema 1: Darstellung der Messung der Wärmetönung in einem Laborfermentor unter adiabatischen Bedingungen
Alle anderen Methoden sind weniger geeignet, da die o.g. Anforderungen unzureichend erfüllt werden.
Ausgehend von den Gedanken zur Messung der Wärmeentwicklung durch die Mikroorganismen, der Erkenntnis aus dem Schema 1, daß eine Erfassung aller Einflußfaktoren mit sehr hohem technischen Aufwand verbunden ist, und den o .g. Anforderungen, soll auf eine Wärmeisolierung weitestgehend verzichtet werden. Da eine absolute Größe des Wärmestromes nicht gefordert ist, besteht die Möglichkeit, mit Hilfe der Wärmebilanz einen Teil der Größen durch Versuchsdurchführung oder rechnerisch zu bestimmen. Diese Werte werden in den Rechner eingelesen und können bei der Auswertung berücksichtigt werden.
Aus diesen Überlegungen heraus können zwei Methoden Anwendung finden:
Für die zweite Methode ist folgende prinzipielle Lösung vorgesehen:
Es erfolgt eine Erfassung der Temperaturdifferenz des Kühlwassers vor und nach dem Wärmetauscher des Bioreaktors mit gleichzeitiger Messung des Durchflusses des Wärmeträgers und der Temperaturänderung des Fermentorinhaltes in der Zeit t0 bis t1. Diese Werte werden als Analogsignale dem Prozeßrechner zugeführt. Weiterhin ist das Wärmegleichgewicht durch Rührleistung, Belüftungsrate, Bildungswärme, Wärmeverlust usw. zu berücksichtigen.
Auf der Grundlage der Gleichung 8 kann die erzeugte Wärmemenge durch das Kühlwasser abgeführt werden. Die Messung erfolgt in einem 12 Liter Laborfermentor, welcher ohne und mit Mikroorganismen betrieben wird. Es sind folgende Meßwerte zu erfassen:
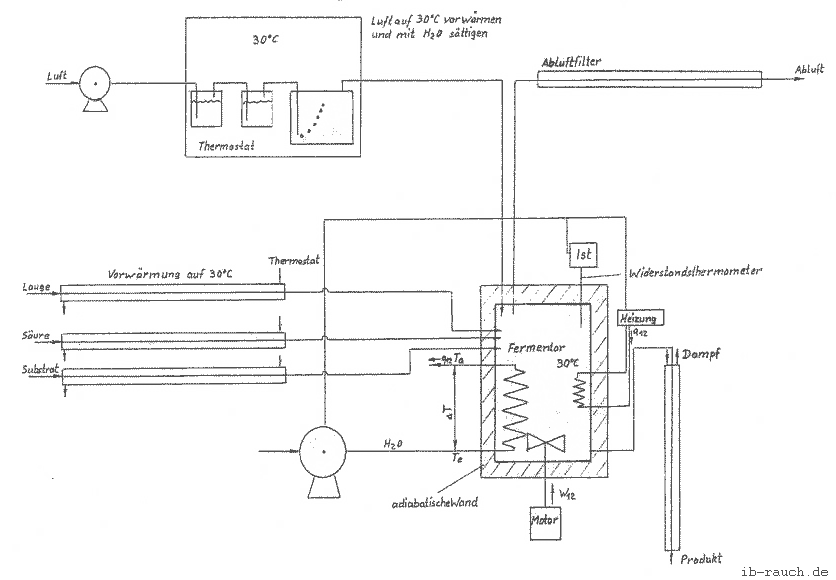
Die Meßstellen sind im Schema 2 dargestellt.
Schema 2: Messung des Wärmestroms im Fermentor
Die Temperatur des Fermentorinhaltes gibt nur in Verbindung mit der Raumtemperatur eine Aussage. Z. B. sind beide Temperaturen gleich, so liegt ein thermodynamisches Gleichgewicht vor. (/7/S.134) Der Fermentorinhalt ist somit nicht in der Lage, Wärme an die Umgebung abzugeben oder aufzunehmen. Für die Messung ist dies von Bedeutung, da bei einer festgelegten Fermentationstemperatur und einer gleich bleibenden Raumtemperatur der Wärmestrom aus dem Fermentor durch praktische Versuchsdurchführungen bestimmbar ist. Die Temperaturänderungen können durch den Prozeßrechner, welcher mit einer entsprechenden Software ausgestattet ist, berücksichtigt werden.
Ausgehend von der Gleichung 12 kann auf nachfolgendem Weg eine Anzeigegröße, die Aufschluß über den Prozeßverlauf gibt, hergeleitet werden.
Der Fermentorinhalt hat meist eine höhere Temperatur als die Umgebung. Es erfolgt somit ein Energiestrom aus dem System. Dieser Abkühlungsprozeß wird. durch das strömende Kühlwasser beschleunigt. Es gilt somit
QZu= QF+ QKW (19),
was bedeutet, bei einer größeren Energiezufuhr erfolgt eine Änderung auch auf der rechten Seite der Gleichung. Da sich der zugeführte Wärmestrom im wesentlichen aus der Luft, des Motors und der Mikroorganismen zusammensetzt, kann die o.g. Gleichung erweitert werden. Sie lautet:
QW+ QM+ QG = QF+ QKW
Die Werte QM und QG können als gleichbleibend betrachtet werden.
Sie sind in einer Versuchsdurchführung zu ermitteln und bei der Signalaufzeichnung zu berücksichtigen. Alle Änderungen bei der Bildungswärme QW kann im wesentlichen durch QF und QKW erfaßt werden. Nach diesem Prinzip erfolgt die Meßwerterfassung und die Anzeige.
Grundlage jeder Temperaturmessung bildet das so genannte thermische Gleichgewicht, das wie folgt definiert ist:
Zwei Systeme stehen dann im thermischen Gleichgewicht, wenn sie die gleiche Temperatur haben.
Zur Temperaturmessung eignen sich temperaturabhängige physikalische Eigenschaften wie z. B. Volumenausdehnung und elektrischer Widerstand. Für die Messung der Temperatur wird das Widerstandsthermometer in einer Brückenschaltung ausgewählt.
Grundlage dieser Meßmethode ist das Ohmsche Gesetz
R = U/I (20)
Daraus ableitend kann die Widerstandsänderung
R0= R0 (αθ + βΔθ2) (21)
bestimmt werden.
Die bei gegebener Strombelastung und Größe der Meßwiderstände höchstmögliche Empfindlichkeit der Brücke läßt sich wie folgt ermitteln:
Wird der Leitungszweig der Brücke aus Rl und R2 betrachtet, so ist dies eine Reihenschaltung, wo die Spannung sich aus
U = U1+ U2 (22)
errechnet. Nach dem Ohmschen Gesetz
U1/ R1 = U2 R2 (23)
kann U1 bei der Auflösung beider Gleichungen ermittelt werden
U1 = R1U / (R1+ R2) (24)
Die Temperaturabhängigkeit des elektrischen Widerstandes ist durch die Beziehung
R = R0(l + αθ) (25)
gegeben. Mittels dieser Beziehung nimmt die Gleichung 24 die Form
U1= U R1,0+ U R1,0αθ / (R1,0+ U R1,0αθ + R2) (26)
an, welche zur Ermittlung der Temperaturabhängigkeit der Spannung U1 sowie des optimalen Verhältnisses von R1zu R2 dient (/25/ S. 33).
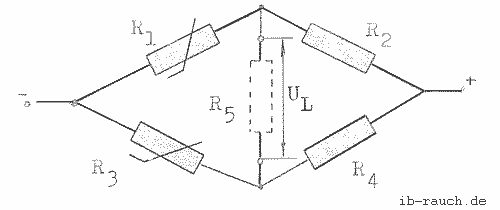
Die Spannung, die bei der Brückenschaltung (Bild 1) abgegriffen und durch das Digital-Multimeter angezeigt wird, kann durch die nachfolgende Gleichung berechnet werden:
U1= U R1/ (R1+ R2) - R2 (R3+ R4) (27)
Der maximale Speisestrom errechnet sich für die abgeglichene Brückenschaltung (R1R4= R2R3)aus.
Imax= Izul(R1+R2±R3±R4) / (R3+ R4) (28)
wobei Izul= 5...l0 mA ist.
Die Speisespannung wird aus dem Außenwiderstand der Brücke
Ra=(R1+R2)(R3+R4) / (R1+R2+R3+R4) (29)
und U = ImaxRa (30)
bestimmt. Der Diagonalstrom Läßt sich aus
I5= U x R1R4– R2R3 (31)
(R1+R2)[R3R4+R5(R3+R4)]+R1R2(R3+R4)
ermitteln /30/.
Bild 1: Brückenschaltung zur Messung der Brückenspannung
Es werden zwei Widerstandsthermometer Pt100 verwendet. Ihr Widerstandsverhalten bei verschiedenen Temperaturen ist der Anlage 2 (/31/ S. 375 u. 378) zu entnehmen. Durch die Einführung neuer Kennwerte für das Pt100 treten in dem Bereich um 30°C keine Veränderungen auf /32/, so daß die in der Anlage 2 aufgeführten Werte weiterhin Gültigkeit haben.
Im Bild 2 wird die verwendete Brückenschaltung dargestellt. Mit ihr wird die Messung der Brückenspannung durchgeführt, die bei dem Temperaturunterschied zwischen dem Kühlwasserein- und -ausgang auf tritt. Die zwei Leitungen des Widerstandsthermometers können den Brückenabgleich fehlerhaft beeinträchtigen, daher ist ein Leitungsabgleich erforderlich. Es erfolgt in der Weise, daß die Leitungswiderstände RL durch abwickelbare oder im Meßumformer einstellbare Widerstände auf einen festgelegten Endwert
Bild 2: Brückenschaltung mit 2 Temperaturmeßfühlern Pt100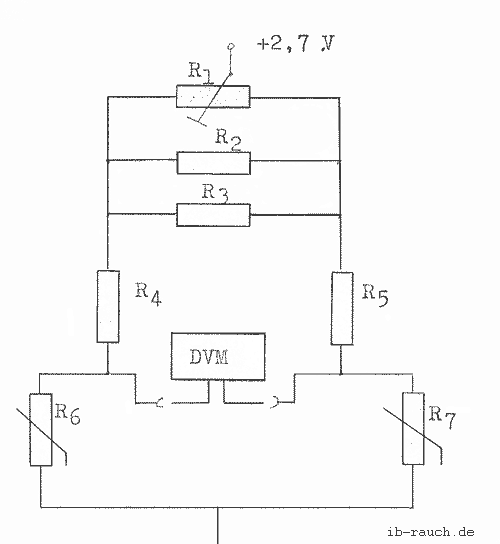
R1= 100 Ω
R2= 22 Ω
R3= 10 Ω
R4= 100 Ω
R5= 100 Ω
R6= 100 Ω (Pt100)
R7= 100 Ω (Pt100)
(z. B. 2RL = 5 oder l0 Ω) ergänzt werden. Um dies zu umgehen, wurden die Leitungen sehr kurz gehalten, so daß nach einer Prüfung des Leitungswiderstandes eine o.g. Maßnahme nicht erforderlich ist. Die Herstellung des Brückengleichgewichts wurde durch den Stellwiderstand an der Spannungsquelle erreicht. Durch die Parallelschaltung der beiden Widerstände ist eine bessere Eichung möglich.
Als Anzeigegerät wurde ein Galvanomenter Gest 10374 - 74 ausgewählt, was sich jedoch auf Grund seines Anzeigebereiches als ungeeignet erwies, so daß ein Digital Multimeter V 543 Anwendung fand. Für die notwendige Spannungslieferung konnte das Spannungsgerät Statron TG 30/1 Verwendung finden.
Der Einbau der Widerstandsthermometer in die Kühlleitung erfolgt schräg gegen die Strömungsrichtung. Bei der Messung in Flüssigkeiten entfällt der Wärmestrahlungsanteil. Zwischen Schutzrohr und Medium besteht ein gutes Wärmeübergangsverhalten. Die Meßfehler sind daher gering. (/31/ S. 400)
Da aus dem bisherigen Text bereits hervorgeht, daß die Temperaturdifferenz zwischen dem Kühlwasserein- und -ausgang mittels in Brücken geschalteter Pt-Widerstandsthermometer erfaßt wird, sollen noch weitere Möglichkeiten diskutiert werden.
Thermistoren in Brückenschaltung
Thermistoren haben bei Raumtemperatur etwa den l0—fachen Temperaturkoeffizienten des elektrischen Widerstandes wie Platin (αTh≈ - 4.l0-2K-1; αPt≈ - 4.l0-2K-1). Während der Koeffizient des Platins im betrachteten Temperaturbereich jedoch annähernd konstant und — was ausschlaggebend ist — bei Verwendung gleichen Platinmaterials für zwei gleichartig konstruierte Thermometer völlig übereinstimmt, ergibt sich α beim Thermistor in kleinen Temperaturbereichen aus der Funktion
log RTh= log R∞ + T/B (32)
mit lim RTh= RTh∞
T → ∞
zu α = - B/T2 (33)
Die Konstanten B differieren zwischen den einzelnen Thermistoren zu stark, um zwischen Raumtemperatur und 100°C eine Übereinstimmung der Temperaturfunktion zu erreichen, die den der Pt100 gleichkommt. Ungünstig ist weiterhin die relativ große thermische Trägheit und Eigenerwärmung. (/29/ S. 29)
Thermoelemente
Im Gegensatz zur Thermistorbrücke wäre ein Einsatz von Thermoelementen zur Temperaturdifferenzerfassung sinnvoll. Es eignet sich die Kombination Konstantan - Chromnickel mit 6,6 mV/100 K und relativ hohem Widerstand besser als z. B. Platin - Platin-Rhodium mit ca. 1 mV/ 100 K. Beim Einbau sind jedoch gewisse Erfahrungen erforderlich. (/29/ S. 30)
Der Einsatz von Computern in der Biotechnologie ist gegenüber der Anwendung in der chemischen Industrie noch nicht so verbreitet. Dies hat einige Gründe:
Es gibt noch nicht genügend geeignete und zuverlässige Sensoren im Sterilbereich für eine volle Ausnutzung der Rechnerkapazität Biosynthese und Regulation der Metabolitbildung sind noch nicht genügend bekannt.
Je nach Ausbauzustand wird der Computer für die Datenerfassung, Datenanalyse und zur Erarbeitung von Fermentationsmodellen eingesetzt. In der Anlage 3 werden wichtige Sensoren für die Meßwerterfassung aufgeführt, die in der technischen Mikrobiologie gebräuchlich sind. Im vorliegenden Fall wird durch die Erfassung der Temperatur, die Aufstellung einer Wärmebilanz ermöglicht. Mit ihr können Informationen aus dem Fermentationsprozeß gewonnen werden, die sinnvoll mit anderen wachstumsbestimmenden Faktoren, wie Gelöstsauerstoff, Kation-, N- und P-Konzentrationen, Wasserstoffaktivität usw. verknüpft und in den Prozeßrechner eingegeben werden können. Treten Abweichungen einzelner oder mehrerer Komponenten auf, so sinkt die Wachstumsgeschwindigkeit infolge veränderten Stoffwechsels. Diese Abweichung kann durch das Absinken der Wärmeproduktion erkannt werden. Je nach der Güte des Meßverfahrens kann mehr oder weniger schnell auf den Prozeß eingewirkt werden. Es wird dadurch möglich, den Optimalbereich weiter einzugrenzen und bisher noch nicht gekannte Wechselwirkungen zwischen den einzelnen Parametern richtig zu deuten. Weiterhin können prozeßhemmende Faktoren, die oft bei der Überleitung von der kleintechnischen zur großtechnischen Anlage auftreten, schneller erfaßt werden.
Ein wichtiger Prozeß bei der Fermentation ist die Regelung der Prozeßtemperatur. Von ihr hängt stark die Wachstumsrate der Mikroorganismen ab. Die biokinetische Zone (zwischen minimaler und maximaler Temperatur) muß daher ständig eingehalten werden. (/33/ S. 273) Die Regelung erfolgt nach unterschiedlichen Methoden, die von Handbetrieb bis zur automatischen Regelung reichen. Interessant sind zwei Regelmöglichkeiten, die den Kühlprozeß eines Fermentors regulieren. Sie sind in der Anlage 4 (/34/ S. l99 u. 200) dargestellt. Bei diesen Systemen läßt sich günstig das vorgeschlagene Meßverfahren zur Bestimmung der Bildungswärme realisieren. Auf der Basis der Zweipunktregler der Wasserkühlung funktioniert z. B. die kontinuierliche Kalorimetrie.
Die für die Versuchsdurchführung eingesetzte Gerätetechnik zur Messung der Temperaturdifferenz des Kühlwasserzu- und -abganges wird aus Einzelteilen aufgebaut und ist daher sehr einfach und kostengünstig. Für die zu lösende Digitalthermometer der Baureihe DTM 2000 (Anlage 5) (/35/ S. 566 ... 568), welches ohne Schwierigkeiten angewendet werden kann.
Eine automatische Meßwerterfassung war vorgesehen, konnte jedoch wegen fehlender materiell-technischer Voraussetzungen in der zur Verfügung stehenden Zeit nicht realisiert werden. Diese Meßeinrichtung sollte aus der Hintereinanderschaltung eines Meßfühlers MF und eines Meßumformers MU bestehen, die über einen Meßstellenumschalter US an den Zentralverstärker ZV geschalten werden, der die Meßsignale an einen .Analog-Digital-Umsetzer ADU zur Digitalisierung (und anschließenden Weiterverarbeitung) übergibt (Bild 3).
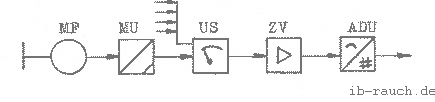
Auf der Grundlage des Prinzips der Meßwerterfassung im Bild 3 wurde eine Schaltskizze entwickelt, die in der Anlage 6 /37/ dargestellt ist. Auf die Fragen der Störbeeinflussung und die damit zu erwartenden Fehler, kann in diesem Rahmen nicht eingegangen werden.
Ebenfalls wie die Temperatur kann auch die Durchflußmenge des Kühlwassers automatisch erfaßt werden. Eine interessante Methode ist die Durchflußmessung mittels Kreuzkorrelation, die in der Anlage 7 (/38/ S. 95) dargestellt wird.
Unter Fermentation versteht man eine gezielte Beeinflussung der natürlichen Stoffwechselvorgänge der Mikroorganismen. Mit Hilfe einer technischen Einrichtung werden optimale Wachstumsbedingungen geschaffen, um eine hohe Ausbeuterate zu erzielen.
Während der Fermentation müssen im Gegensatz zur chemischen Verfahrenstechnik, wo sehr häufig homogene, flüssige Phasen miteinander reagieren, Dreiphasensysteme umgesetzt werden:
In der Fermentation finden vorwiegend Hefen, Bakterien und Algen für die Herstellung von SCP, Enzymen, Antibiotika, org. Säuren, zur Aufarbeitung von Erzen, Abwässern u.a.m. Verwendung. Diese Prozesse können sowohl aerob (Oxidation des Energieträgers, d. h. es wird O2 benötigt) als auch anaerob (der Energieträger wird in eine energieärmere Verbindung abgebaut, hier wirkt sich die Anwesenheit von Sauerstoff störend aus) erfolgen.
Hierfür gibt es verschiedene Fermentorsysteme, z. B. Rühr-, Tauchstrahl-, Wirbelbett-, Airlift-Schlaufenfermentor u.a., die zum Einsatz kommen. Das Prinzip besteht darin, die Mikroorganismen mit geringem Energieaufwand ausreichend mit Sauerstoff zu versorgen, der für die Oxidation des Substrates benötigt wird. Die daraus gewonnene Energie wird für den Zellaufbau und für den Stoffwechsel der Mikroorganismen benötigt. Bei der Fermentation werden auch noch andere optimale Lebensbedingungen, wie z. B. Temperatur, Wasserstoffaktivität, Gelöstsauerstoff u.a.m., geschaffen. In der Praxis finden zwei Fermentationsregime, die batch und die kontinuierliche Methode, Anwendung. Das Betreiben dieser Anlagen ist sehr kompliziert und bedarf eines gut ausgebildeten Bedienungspersonals. Meist bilden langjährige Erfahrungen die Grundlage einer reibungslosen Fahrweise. Oft wird nur das optische Aussehen der Kultur zur Bewertung des Wachstumsstadiums herangezogen, da zu wenige Prozeßdaten dem Anlagenfahrer zur Verfügung stehen. Die im Labor ermittelten Untersuchungsergebnisse geben später genaueren Aufschluß.
Die Meßwerterfassung, die für das Fahren eines Fermentors eine wichtige Voraussetzung ist, bringt auch Nachteile. Das Vorhandensein von pH-Elektroden und anderer Meßfühler im Reaktor erhöht die Unsterilität nachweisbar. Des weiteren sind diese Meßfühler in vielen Fällen nicht sterilisierbar oder müssen ständig ausgebaut werden. Bei acitophilem Sterilfermentationsbetrieb überwächst meist die Kultur die Fremdverkeimung, so daß eine l0O%ige Sterilität nicht unbedingt gegeben sein muß. Die meisten Mikroorganismen leben im neutralen Bereich, so daß bei der fermentativen Züchtung einer neutrophilen Kultur die Gefahr einer Fremdverkeimung sehr groß ist und mit jeder zusätzlichen Meßeinrichtung im Sterilbereich anwachsen kann. Aus den genannten Gründen ist also ein Meßverfahren zur Prozeßführung auszuwählen, wo kein direkter Kontakt zu den Mikroorganismen besteht. Z. B. in der Enzymanlage Nordhausen werden der O2-Eintrag, Druck- und Leistungseintrag als Prozeßgrößen erfaßt. Dies sind Meßwerte, die nicht unmittelbar Aufschluß über den Zustand der Kultur sowie über die Enzymbildung geben. Die Messung der Wärmeentwicklung wurde beim Einsatz in der o.g. Anlage über die Wachstumsentwicklung der Kultur sowie die Enzymbildung Auskunft geben und es können höhere Ausbeuten erzielt werden.
Es ist davon auszugehen, daß alle Methoden, wie genetische Bearbeitung, Regulation des Stoffwechsels durch Nährstoffoptimierung oder optimale Sauerstoffversorgung unter sterilen Bedingungen nur Hilfsmittel bei der Versorgung der Zelle sind. Je genauer die Stoffwechselvorgänge während des Wachstums und der Substanzbildung erfaßt und verstanden werden, um so weiter gelangt man bei der Fermentation zum gelenkten Prozeß. Das vollautomatisch ablaufende, computergesteuerte Verfahren zur Substanzgewinnung mit Hilfe der Fermentation bleibt zur Zeit jedoch nur ein Traum.(/39/ S. 50) In der Zwischenzeit sind jedoch vielseitige Versuche auf dieser Strecke unternommen worden, so daß labortechnische Anlagen bereits automatisch gefahren werden können.
Mit Hilfe dieses Laborfermentorsystems, welches mit einem Prozeßrechner K 1520 und zusätzlich mit einem MC 80 gekoppelt ist, soll die Wärmetönung der Hefekultur gemessen werden.
Das Fermentorsystem besteht aus einem maschinentechnischen Anlagenteil, einem Meß-, Steuer- und Regelteil und einem Datenteil. Mit dem Fermentor - Mikrorechner - System können eine Vielzahl biologischer und technischer Untersuchungen durchgeführt werden. Aus diesem Grund besteht eine große Flexibilität in der Hard- und Software.
Mit dem System kann sowohl im batch als auch im kontinuierlichen Betrieb gefahren werden. Der Mikrorechner K 1520 hat den Vorteil, daß das Rechnersystem ganz auf die zu steuernden Prozesse einstellbar ist. Der Rechner ist unter Laborbedingungen betreibbar und kann unmittelbar neben dem Fermentor aufgestellt sein. Die Leistungsfähigkeit ist ausreichend für die Durchführung des vorgesehenen Versuches. Die Meß- und Steuerstellen sind in der Anlage 1 /40/ und die technischen Daten in der Anlage 8 (/41/ S. 5) aufgeführt.
Zunächst soll kurz dargestellt werden, wie sich die Wachstumsentwicklung der Mikroorganismen vollzieht. Aus dem Bild 4 (/42/ S. 72) läßt sich erkennen, daß in den jeweiligen Entwicklungsstufen der Mikroorganismen unterschiedliche Energiemengen erzeugt werden.
Dies wird ganz deutlich, wenn synchronisierte Kulturen verwendet werden. Die Anlage 9 (/29/ S. 45) zeigt eine tabellarische Darstellung der synchronisierten Kultur Saccharomyces cerevisiae, woraus deutlich hervorgeht, daß die Wärmelieferung von der Wachstumsentwicklung und der Größe der Zelle abhängt.
Bild 4: Entwicklungskinetik (/42/ S. 72)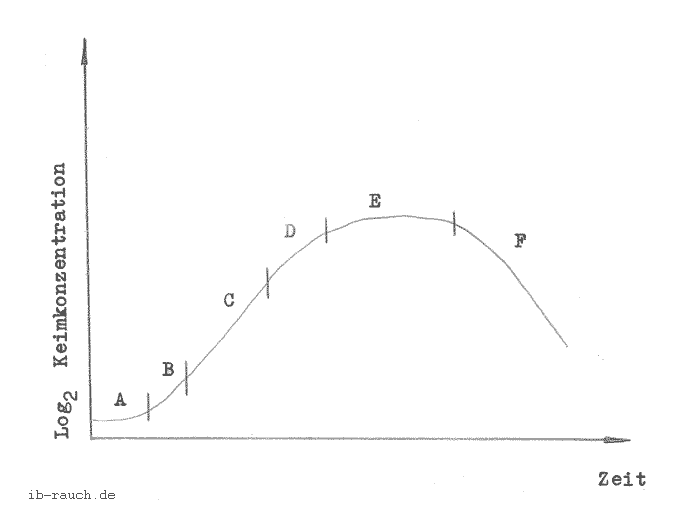
Die einzelnen Abschnitte bedeuten:
Um eine optimale Ausbeute zu erzielen, muß die Fermentation unter konstanter Temperatur gefahren werden. Es ist also ständig soviel Wärme abzuführen, wie im Fermentor erzeugt bzw. diesem zugeführt wird.
Von Interesse ist die Wärmeproduktion durch den Mikroorganismus, der über den Ertragskoeffizient Ykcal bestimmt wird. Er wird errechnet aus:
Ykcal= YS/ HS– YS HC (34)
Die Literatur verweist auf Ykcal = 0,0294 g kJ-1 durch die Kultur Saccharomyces c. bei minimalem Glucoseverbrauch. /43/ Der Energiebedarf und die Wärmeerzeugung können für die Kultivierung recht gut abgeschätzt werden. /44/
Der Ertragskoeffizient Ykcal wird in g Zellen/kJ (freigesetzt) angegeben, YS ist g Zellen/g Substrat, die Verbrennungswärme HS des Substrates ist in kJ/g und die Verbrennungswärme HC der Biomasse ebenfalls in kJ/g einzusetzen. Während es für die Verbrennungswärme verschiedener Substrate Tabellen gibt, muß die Verbrennungswärme der Zellen (HC) entweder experimentell bestimmt oder aber nach verschiedenen Methoden errechnet werden. /45/
Die mikrobielle Wärmebildungsrate pro Zeiteinheit, die neben dem Wärmeeintrag durch den Rührer aus dem Bioreaktor entfernt werden muß, errechnet sich aus Zellbildungsrate, Reaktorvolumen und Wärmekoeffizient:
Zellbildungsrate dX/dt = • X (35)
Wärmebildungsrate QW= V • μ • X • 1/Ykcal (36)
Wird die Wärmebildungsrate der Kultur Saccharomyces c. für 1 g/l mit der Wachstumsrate = 0,5 h-1(/29/ S. 36) bestimmt, so ergibt das
QW = 1,0 l • 0,5 h-1• 1 g l-1 • 1 KJ/0,0294 g
= 4,722W .
Auf Grundlage dieser Größe soll die Versuchsdurchführung erfolgen.
Die totale Verbrennung (beim Atmen) von Glucose verläuft nach folgender Gleichung
06H1206+ 6 O2 ---> 6 C02+ 6 H20
Aus entsprechenden Tabellen können für 25°C folgende Werte der molaren freien Standardbildungsenthalpie entnommen werden.
06H1206: - G° = - 916,78 kJ mol-1
6 CO2(g): - G° = 6 • 394,36 kJ mol-1 = 2366,16 kJ mol-1
6 H2O(f): - G° = 6 • 237,15 kJ mol-1 = 1422,90 kJ mol-1
G° = (-2366,l6 - 1422,90 + 916,78)kJ mol-1
G° = - 2872,28 kJ mol-1
Die Verbrennung eines Mols (180 g) Glucose bei 25°C wird demnach von einer Abnahme der freien Standardenthalpie um 2872,28 kJ begleitet. Die genannte Reaktion erfolgt durch aerobe Respiration, wo hingegen bei der anaeroben Fermentation Milchsäure oder Ethanol entsteht.
---> 2 OH3—CHOH—000H G0= — 197 kJ mol-1
C6H12O6 ---|
---> 2 C2H5OH + 2 C02 G0= — 234 kJ mol-1
Es wird ersichtlich, daß bei anaeroben Bedingungen nur etwa 10% der verfügbaren Energie abgebaut werden. (/46/ S.363) Experimentell wurde bei dem Glucoseabbau durch mikrobielle Zellen eine Wärmemenge von 2806,2 kJ mol-1nachgewiesen. /43/
Weiterhin wurde festgestellt, daß die biologische Glucoseoxidation während des Atmens bei 25°C ΔG°= - 2878 kJ mol-1liefert. (/5/ S. 315)
Aus den vorangehenden Ausführungen läßt sich erkennen, daß die Wärmebildungsrate eines biologischen Systems nicht einfach bestimmbar ist. Zu dem mikrobiellen Stoffwechsel wurde ein umfangreiches Modell entwickelt und berechnet. /47/
Die Hefezellen Saccharomyces c. vermehren sich durch Sprossung. Das Erscheinen einer Knospe an der Zellwand läßt sich im Mikroskop sehr genau beobachten, so daß man dieses Ergebnis dazu benutzen kann, eine Zellzykluszeit zu definieren.
Die Zellzykluszeit t0 wird als die Zeit zwischen dem Erscheinen der ersten und der zweiten Knospe einer Zelle definiert. Die Vorgänge dieses Zellzykluses kann man in verschiedene Phasen einteilen /48/. Das Alter a der Zellen zu einer bestimmten Zeit t wird definiert durch
a = t - to / tc (37)
wobei t0 der Beginn der Zykluszeit ist. Er ist von Umweltbedingungen und der Arbeitsmethode abhängig.
Bevor sich die Mutterzelle und die Tochterzelle voneinander getrennt haben, werden neue Knospen von Mutter- und Tochterzelle gebildet. Da die Bestimmung der Zellzykluszeit mikroskopisch durchgeführt wird, läßt sich dieser Zeitpunkt schlecht bestimmen. (/29/ S.22)
Für die Fermentation kann z. B. folgendes Nährmedium verwendet werden:
Die Anlage 10 /49/ gibt Auskunft über die mineralische Zusammensetzung für die kontinuierliche Fermentation.
Für die Messung der Wärmeproduktion ist der Einsatz von Hemmstoffen wie das antibakterielle Antibiotikum Polyen (Nystatin) günstig. Bei der Hefe fällt die Wärmeproduktion pro Zelle nach Zugabe von 5, 10 und 2O μg/ml Nystatin auf 41, 38 und 28% des maximalen Wertes ab und bleibt dann konstant (/29/ S. 47).
Bei der Kultivierung von Saccharomyces c. hat schon Pasteur erkannt, daß sich die Gärung durch eine kräftige Durchlüftung des Substrates fast vollständig zugunsten des Wachstums unterdrücken läßt. Es werden kaum noch Ethanol und CO2 gebildet, dafür aber von der Hefezelle, die bei der alkoholischen Gärung nur 2 M ATP pro M Glucose gewinnt, auf oxidativem Wege 38 M ATP pro Mol veratmeter Glucose gewonnen, die zum Aufbau von Zellmaterial verwendet werden können.
Die theoretische Sauerstoffmenge für die Verbrennung von 1 g Zellsubstanz zu CO2, H20 und NH3 ist 934 ml 02.
Diese Hefe ist fakultativ aerob/anaerob und wird trotz ihrer guten Gäreigenschaften zum aeroben Mikroorganismus gezählt. (/42/ S. 93 u. 94)
Die Regulation des Wirkungsgrades (Atmung - Gärung) wird durch mehrere Mechanismen bestimmt, die in der aufgeführten Literatur näher erläutert werden:
Die wachsende Kultur besitzt eine kurze konstante Phase, die 30 Minuten dauert. Danach erfolgt ein steiler Anstieg der Wärmeproduktionskurve während des expotentiellen Wachstums der Zellen.
Die Wärmeproduktionskurve der gesamten Kultur verläuft über einen Zellzyklus linear mit einer Steigerung von etwa 0,03 x l0-5W/ml h.
Am Ende der Anstiegsphase (nach etwa 2 ... 2,5 h) erreicht die Wärmeproduktion pro Zelle ein Maximum. Dem anschließenden Abfall der Kurve auf 61 ... 79% des maximalen Wertes folgt ein zweites Maximum. Die maximale Wärmeproduktion liegt zwischen 9,1 ... 9,8 x 10-12W/Zelle (/29/ 8.41 ... 44). Das Wachstum der Hefe wird in der Anlage 9 als Tabellenform dargestellt. Da es sich hierbei um synchronisierte Zellen handelt, ist sie sehr anschaulich.
Mit dem Versuch ist die Funktionsfähigkeit der Meßeinrichtung mit der Hefekultur Saccharomyces c. nach zu weisen.
Als Erstes ist eine Eichkurve aufzustellen, damit eine Umrechnung der angezeigten Brückenspannung in die vorhandene Differenz bei der Kühlwasserein- und -ausgangstemperatur erfolgen kann.
Durch eine Reihe von Teilversuchen sind auftretende Störgrößen zuerkennen und weitestgehend zu beseitigen. Es ist unter anderem der vorhandene Wärmestrom unter produktiven Bedingungen ohne Hefekultur zu bestimmen, damit der ermittelte Wert bei der Messung der Wärmeproduktion durch die Mikroorganismen berücksichtigt werden kann. Durch den Einsatz von elektrischen Heizwiderständen ist eine definierte Wärmezuführung in das System möglich. Es ist somit eine Beobachtung des Signalverlaufes bei Niveauänderung gegeben. Durch den Einsatz der o.g. Hefekultur sollen die erreichten Ergebnisse und damit die Anwendbarkeit bestätigt werden.
Zur Durchführung des Versuches sind folgende Geräte und Materialien notwendig:
1 Laborfermentorsystem LFS 212
2 Widerstandsthermometer Pt100 in Brückenschaltung
1 Digital Multimeter V 543
2 Spannungsgeräte Statron TG 30/1
2 Meßzylinder 1000 und 50 ml
4 el. Verbindungsleitungen
3 Widerstände 10 ~2 (0,1 ‚ 0,5 und 1 W)
1 Schlauchklemme zur Kühlwasserregulierung
1 7,0 l Wasserbehälter mit Regulierhahn
Wasserschläuche
1 Thermometer
1 Stoppuhr
Als Basis für den Versuch dient das Laborfermentorsystem LPS 212, welches im Pkt. 5.2. beschrieben wird. Der Aufbau der Brückenschaltung ist im Pkt. 3.2.2. und die Meßwerterfassung der Temperatur im Pkt. 3.1. beschrieben.
Die Kühlwasserversorgung erfolgt über ein Schlauchsystem von der Wasserleitung zum Fermentor und zurück zum Abfluß. In die Kühlschläuche sind die Widerstandsthermometer unmittelbar vor bzw. nach den Kühlwasserstutzen, welche sich am Fermentortisch befinden, eingebaut und abgedichtet.
Die Regulierung des Kühlwasservolumens erfolgt über einen Wasserhahn zur Grobeinstellung und eine Schlauchklemme zur Dosierung. Das Volumen der Durchflußmenge wird mit einem Meßzylinder und einer Stoppuhr bestimmt. Ebenso ist das Auslitern des Fermentorinhaltes erforderlich, da die Massenanzeige des Fermentors bis zu einem kg vom Sollwert abweicht. Dies wurde beim Befüllen des Behälters festgestellt.
Die Temperaturen für die Berechnung des Wärmestromes können:
Die Temperaturdifferenz kann am Digital Multimeter nicht abgelesen werden. Es muß daher eine entsprechende Umrechnung der angezeigten mV in K erfolgen. Für solche Fälle wird eine Eichkurve aufgebaut. Aus der Literatur geht hervor, daß sich die Temperaturänderung linear zur Änderung der Brückenspannung verhält.
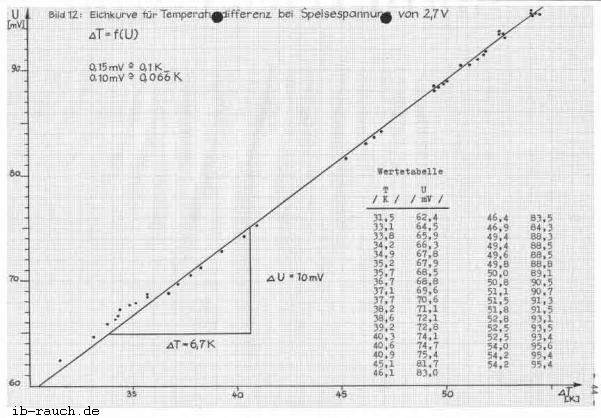
Als erstes ist es notwendig eine Bezugstemperatur zu schaffen, die während der Versuchsdurchführung unverändert bleibt. In einem mit Eis gefüllten Thermosbehälter werden beide Widerstandsthermometer eingesteckt und die Brückenspannung auf 0,00 mV eingestellt. Dies erfolgt mit Hilfe des Stellwiderstandes (Bild 2). Ein Widerstandsthermometer verbleibt im Thermosbehälter, wohingegen der andere in einen mit Flüssigkeit gefüllten Behälter eingetaucht wird. Die gut gerührte Flüssigkeit wird gleichmäßig von 22 auf 55°C erwärmt. Zu der jeweiligen Temperatur wird die angezeigte Spannung am Digital Multimeter abgelesen. Die ermittelten Werte werden in einem Koordinatensystem (Bild 12) aufgetragen, wobei die Temperaturdifferenz als Funktion der Brückenspannung dargestellt ist. Bei den ermittelten Werten liegt nur eine geringe Streuung vor. Aus dem Diagramm kann die Temperaturdifferenz der jeweilig angezeigten Brückenspannung abgelesen werden, wobei 1 mV = 0,666 K entspricht. Die Brückenspannung kann mit einer Sicherheit von 0,03 mV abgelesen werden. Nach dem Diagramm entspricht das einer Temperaturdifferenz von 0,02 K.
Nach der Beendigung der Temperaturdifferenzmessung erfolgt nochmals eine Überprüfung der Eichung beider Widerstandsthermometer nach den o.g. Verfahren. Anhand der ermittelten Meßwerte wird eingeschätzt, daß diese Methode zur Messung der Temperaturdifferenz des Kühlwassers geeignet ist. In der Praxis treten bei den großtechnischen Anlagen Temperaturdifferenzen bei dem Kühlwasser zwischen 5 und 10 K auf, so daß die meßbare Temperaturänderung von 0,02 K die gestellte Forderung von ΔT = 0,1 K übertrifft.
Mit der Größenbestimmung der einflußnehmenden Energieströme aus dem Fermentor, welcher sich aus der Konvektion, Enthalpieänderung der Luft, Rührleistung, u.a.m. zusammensetzt, soll eingeschätzt werden, ob auf das notwendige technische Umfeld, wie es im Schema 1 dargestellt ist, verzichtet werden kann. Der ermittelte Wert ist bei der Signalaufzeichnung zu berücksichtigen. Es sind konstante Betriebsbedingungen zu schaffen. Die Rührleistung beträgt 305 U/min, der Luftdurchsatz 360 l/h und die Temperatur des Fermentorinhaltes um 30°C.
Der Fermentor wurde entsprechend der Betriebsvorschrift gefahren und die o.g. Betriebsbedingungen eingestellt. Es wurden 10 Temperaturwerte abgelesen und ein Durchschnittswert gebildet, die in der Tabelle 1 (oberer Teil) aufgeführt sind.
Die Berechnung der Wärme des Fermentorinhaltes, bezeichnet wird hier die Energie, die an die Umgebung abgegeben werden muß, um ein thermodynamisches Gleichgewicht zu bilden, erfolgt nach der Gleichung:
Q = V φ c(T1-T0)
= 5,58 l x 1 kgdm-1x 4,187 kJkg-1K-1x (30,l—25,7)K
= 102,8 kJ
Der Wärmestrom aus dem System zur gleichen Zeit wird wie folgt berechnet:
Q = m c(T1-T0) t-1
= 5.58 l x 1 kg x 4.187 kJ x(30,39—29,82)KaW
dm3Kg K 1200 s J
= 11,10 W
Nach der Gleichung 1 ist die abgeführte Wärme q12 größer als die zugeführte Arbeit w12, so daß sich der Energieinhalt im Zustand 2 u2 gegenüber dem Energieinhalt des Zustandes 1 u1 verkleinert. Durch die Annäherung beider thermodynamischen Systeme (Fermentorinhalt und Umgebung) wird die Wärme des Fermentorinhaltes verkleinert. Es besteht in dem betrachteten Bereich eine lineare Abhängigkeit (Bild 5).
Bild 5: Abhängigkeit des Wärmestromes aus dem Fermentor von der Wärme des Fermentorinhaltes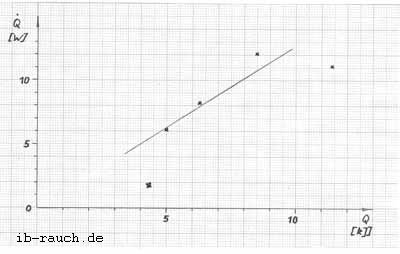
Es ist zu beachten, daß der Anstieg der Geraden durch die Rührerdrehzahl, dem Luftdurchsatz und die Dichte des Mediums im (Fermentor (andere spezifische Wärmekapazität) bestimmt wird. Betrachtet man aus der Tabelle 1 die Zeile 5 und vergleicht diesen Wert mit dem auf der Geraden im Bild 5, so ist festzustellen, daß bei gleichen Bedingungen einmal ohne und mit Rührer (305 U/min) etwa dreimal soviel Wärme aus dem System entzogen wird. Durch die zunehmende Rührerdrehzahl wird eine unterschiedliche Strömungsform der Grenzschicht gebildet, was ausschlaggebend für die Konvektion ist. In der großtechnischen Anlage, z. B. die Enzymanlage des VEB Nordbrand, ist der Fermentor mit einer Wärmeisolierung versehen, so daß die Wärmekonvektion nur gering ist.
Mit der Erprobung der Abführung von Wärme aus dem System durch das Kühlwasser soll die Funktionstüchtigkeit der Meßeinrichtung überprüft werden. Es soll vor allem festgestellt werden, ob vom Digital-Multimeter eine Brückenspannung von > 0,0 mV angezeigt wird.
Der Fermentor wurde entsprechend der Betriebsvorschrift gefahren. Es wurde keine Luft in den Fermentor eingeblasen. Die Berechnung der einzelnen Werte erfolgt wie unter Pkt. 7.4.2.2. Für die Wärmeaufnahme durch das Kühlwasser wird die Gleichung 8 verwendet. Der abgelesene Wert auf der Anzeige des Digital Multimeters wird in die Eichkurve (Bild 12) aufgetragen und es kann die dazugehörige Temperaturdifferenz abgelesen werden (Zahlenbereich beachten!). Die Berechnung erfolgt nach
QKW= 0,78 kgh-1 x 4,187 kJKg-1K-1x 0,59 K x WsJ-1
= 0,54 W
Aus den 10 abgelesenen Werten wird ein Mittelwert gebildet, der in der Tabelle 1 (unterer Teil) aufgeführt ist.
Aus den Meßwerten in der Tabelle 1 kann keine grafische Auswertung erfolgen, da zwischen den einzelnen Meßwerten kein Zusammenhang besteht.
Der Energieentzug aus dem System Fermentor liegt zwischen 0 und 9,1 W. Es konnte jedoch über einen Zeitraum von 5,5 Stunden der Bereich von 1,3 bis 4,2 W eingehalten werden, wobei gleichzeitig die Wärmeaufnahme durch das Kühlwasser berücksichtigt werden muß. Die ermittelten Meßwerte der Temperaturdifferenz des Kühlwassers sind für eine Auswertung nicht brauchbar, da zu viele Störgrößen einwirkten. Das sind unter anderem:
Bei der Versuchsdurchführung konnte festgestellt werden, daß das Widerstandsthermometer sehr rasch auf größere Temperaturänderungen des Kühlwassers reagiert. In 60 s wurde eine Änderung von 13 mV = 8,7 K angezeigt.
Mit einem definierten Heizwiderstand wird Elektroenergie in Form von Wärme dem Fermentorinhalt zugeführt und dessen innere Energie erhöht. Gleichzeitig sind im Teilversuch Pkt. 7.4.3. Störgrößen festgestellt worden, diese sind weitestgehend zu beseitigen.
Der Fermentor wurde entsprechend der Bedienvorschrift gefahren und eine Drehzahl von 300 U/min und ein Luftdurchsatz von 360 1/h eingestellt. Die Betriebstemperatur liegt bei 30°C.
Der Widerstand, 10 Ω(0,1 W), wurde in das Thermometergehäuse des Fermentors eingebaut und an ein Spannungsgerät angeschlossen. Die Heizleistung wird nach der Gleichung
Pel = U I (38)
berechnet.
Es wurde eine Spannung eingestellt und die Stromstärke am Meßgerät abgelesen, so daß folgende Heizleistung zur Verfügung standen:
Pel1= 3V x 0,3A = 0,9 W
Pel2= 3,8V x 0,4A = l,5 W
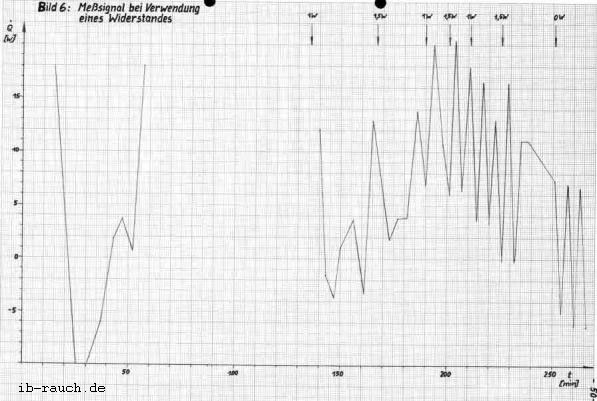
Mit den ermittelten Meßwerten (Tabelle 2) erfolgt nach der Gleichung 19 die Berechnung des Signals, welches im Bild 6 dargestellt wird. Die Leistung des Widerstandes wird mit dem Spannungsgerät eingestellt und nach Bedarf verändert.
Das Bild 6 zeigt ein stochastisches Signal mit einer Abweichung bis 16 W unter gleich bleibenden Bedingungen. Die wesentliche Ursache wird in der Meßfehlergrenze von ± 0,1 K des Thermometers im Fermentor gesehen. Damit ist die Messung eines Wärmestromes von 1 W schlecht möglich. Auch eine Mittelwertbildung aus 10 Temperaturwerten (in 50 s) konnte diese Meßfehler nicht wesentlich verkleinern.
Der Energieentzug aus dem System Fermentorinhalt durch das Kühlwasser konnte durch den höheren Volumenstrom stabilisiert werden, wobei hier noch Schwankungen auftreten. Durch die Druckänderungen in der Wasserleitung mußte der Durchfluß öfter nach reguliert werden, so daß über 3,75 Stunden ein Volumenstrom zwischen 2,4 und 5 l/h, mit einem Durchschnitt von 3,5 l/h, vorliegt.
Eine Auswertung des Meßsignals im Bild 6 ist nicht möglich. Die zugeführte Wärme in das System durch den Heizwiderstand (0,9 und 1,5 W) läßt keine klare Veränderung erkennen. Der registrierte Signalverlauf muß als stochastisches Signal eingeordnet werden, daß heißt, über den gezeichneten Zeitbereich hinaus ist keine genaue Voraussage künftiger Temperaturwerte bzw. Wärmeströme möglich. Es ist jedoch ein Unterschied zwischen dem Zeitabschnitt, wo zusätzlich Energie durch den Heizwiderstand zugeführt wird und dem ohne Heizung zu erkennen. Die aus dem System entweichende Wärme q12 wird bei der Signalaufzeichnung vernachlässigt.
Verbesserung und Stabilisierung des Kühlwasserstromes sowie der Temperaturmessung im Fermentor (soweit dies möglich ist). Erhöhung der Anzahl von Meßwerten und Verringerung der Meßfehler.
Es steht der Widerstand 10 Ω 0,5 W zur Verfügung. Der 1 W Widerstand konnte wegen seiner Größe nicht in das Schutzrohr eingebaut werden.
Die Spannung wurde am Spannungsgerät eingestellt und die Stromstärke konnte am gleichen Gerät abgelesen werden, so daß nach der Gleichung 38 folgende Heizleistungen zur Verfügung standen:
Pel1 = 3V x 0,328A = 0,98W
Pel2 = 4V x 0,435A = l,74W
Pel3 = 5V X 0,530A = 2,65W
Die Versuchsdurchführung erfolgt analog Pkt. 7.4.4.2., ebenso die Ermittlung der Meßwerte, welche in der Tabelle 3 aufgeführt werden.
Im Bild 7 werden die in der Tabelle 3 ermittelten Werte grafisch dargestellt. Die Anlaufphase des Versuches beträgt etwa 1 Stunde. Die Abweichung des Meßsignals bei gleicher Bedingung konnte auf 3 ... 4 W verringert werden. Nicht zufriedenstellend sind die erfaßten Temperaturwerte des Mediums im Fermentor. Ebenso konnte der konstante Kühlwasserdurchfluß nicht erreicht werden, so daß zwei “ausreißer“ in der grafischen Darstellung auftreten. Gegenüber dem vorherigen Versuch ist die zusätzliche Energiezuführung durch den Heizwiderstand erkennbar. Der Signalverlauf ist als analog stochastisch einzuordnen, daß heißt, die Amplitude kann innerhalb bestimmter Grenzen beliebige Zwischenwerte annehmen. Für die nachfolgenden Werte konnte ermittelt werden:
| für die zusätzliche Energiezuführung | ein Signal von |
| 0,0 W 1,0 W 1,7 W 2,6 W | - 4,8 ... 3,8 W 1,6 ... 4,8 W 2,0 ... 8,8 W 3,2 ... 10,2 W |
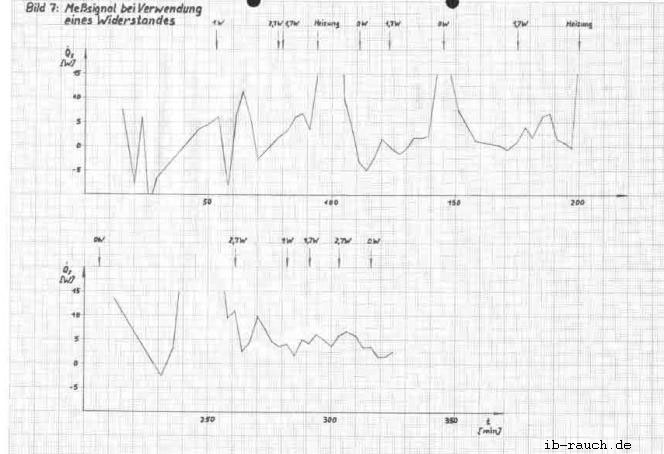
Die Extremwerte des Schwankungsbereiches xmin und xmax überlagern die anderen zu messenden Bereiche, wohingegen das xmin und xmax mit zunehmender zusätzlicher Energiezuführung ansteigen. Da weiterhin noch eine starke Streuung der Meßwerte vorliegt, wurde die aus dem System entweichende Wärme q12 bei der Signalaufzeichnung vernachlässigt.
Um die Druckschwankungen in der Wasserleitung, die sich, nachteilig auf den Volumenstrom auswirken, zu umgehen, ist ein Wasserbehälter mit Zu- und Ablauf aufzustellen. Gleichzeitig ist die Kühlwasserleitung zwischen dem Wärmetauscher und der Meßstellen zu isolieren.
Der 7 Liter Wasserbehälter mit Zu- und Ablauf für das Kühlwasser wurde an der höchsten Stelle im Raum aufgestellt. Es konnte allerdings nur ein Höhenunterschied gegenüber dem Fermentor von 1 Meter erreicht werden, da die Raumhöhe nur ca. 2,2 m beträgt. Damit konnte ein Schweredruck von
p = φg h (39)
= 1000 kgm-3x 9,81 ms-2x 1 mkPa ms2kg-1
= 9,81 kPa
erreicht werden. Dieser Druck reicht nur für einen max. Durchfluß von 60ml/min aus. Diese Durchflußrate ist wegen des Leitungsquerschnittes begrenzt.
Die Kühlwasserleitung wurde in dem angegebenen Bereich isoliert. Dabei wurde festgestellt, daß die Kühlwasserleitung nach dem Wärmetauscher sehr nah am Gehäuse des Antriebsmotors vorbeiführt. Der Fermentor wurde entsprechend der Betriebsvorschrift mit einer Rührerdrehzahl von 305 U/min gefahren. Eine Belüftung entfiel.
Das Fermentorvolumen beträgt 5 l und die Temperatur um 30°C. Die bei der Versuchsdurchführung ermittelten Werte sind in der Tabelle 4 aufgeführt. Im Bild 8 wird das erhaltene Signal aufgezeichnet.
Bild 8: Wärmeentzug aus dem System Fermentor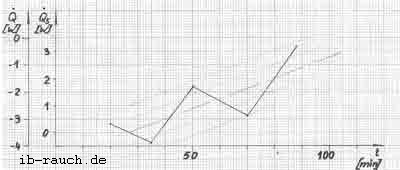
Ein kontinuierlicher Kühlwasserfluß konnte nicht gewährleistet werden. Er fiel bereits nach einer Stunde ab, obwohl alle äußeren Bedingungen unverändert blieben. Der Energieentzug aus dem Fermetorinhalt wird mit fortschreitender Zeit kleiner, da das Niveau der inneren Energie des Systems niedriger wird. Es erfolgt daher eine Verdrehung der Achsen des Koordinatensystems um den Wert, wie die lineare Niveauveränderung erfolgt. Der Nullpunkt wird auf der Ordinatenachse verschoben.
Weiterhin kann festgestellt werden, daß durch die Isolierung der Kühlwasserleitung eine geringere Energieaufnahme durch das Kühlwasser erfolgte als bei den vorangegangenen Versuchen. Der Antriebsmotor hat demnach das Kühlwasser zusätzlich erwärmt.
In den Bewertungen der Teilversuche wurden im wesentlichen die aufgetretenen Meßfehler ermittelt, um sie in der darauf folgenden Versuchsdurchführung zu beseitigen bzw. zu verkleinern. Die Meßwerterfassung während der Versuchsführung unterlag einer ständigen Beeinflussung durch Störgrößen, die im lokalen inneren und äußeren Bereich zu finden sind. Bei der Erprobung der Meßeinrichtung konnte nur ein stochastisches Analogsignal aufgezeichnet werden. Sowie die Störgrößen auf den Fermentationsprozeß (Bild 9) wirken, so wird auch zwangsläufig die Meßeinrichtung beeinflußt.
Bild 9: Prozeßgrößen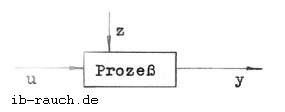
In (/40/ S. 29 ... 32) wird die von BALZER /54/ vorgeschlagene Darstellung der Störgrößen, als eine Summe unabhängig voneinander wirkender Zufallsprozesse dargestellt. Einige dieser Störgrößen sollen hier aufgeführt werden:
| Z1(t) - | zufällige diskrete Schwankungen mit relativ großer Amplitude. Derartige Störungen werden durch die Meßfehler von der Temperaturmessung der Fermentorflüssigkeit und des Kühlwassers, der Druckschwankungen beim Wärmeträgerflusses sowie durch Steuereingriffe des Anlagenfahrers verursacht. |
| Z2(t) - | Extrem niederfrequente Änderungen der Ausgangsgrößen, wobei die Änderung oft in eine Richtung läuft. Das sind die Enteichung der Meßbrücke und die Eigenerwärmung der Widerstände, sowie die Erwärmung des Kühlwassers durch den Antriebsmotor (Strahlung). |
| Z3(t) - | Diese Klasse von Störgrößen beinhalten im wesentlichen zufällige Meßfehler, die in der gesamten Meßeinrichtung zu suchen sind. Dabei handelt es sich sowohl um kontinuierliche Zufallsprozesse mit kleiner Amplitude, als auch um diskrete Zufallsprozesse mit erheblichen Amplituden (“Ausreißer“). |
Die genannten Störgrößen beeinflussen den Meßprozeß des Versuches (Pkt. 7.4.5.) so, daß die Amplitude eine Schwankungsbreite bis 8,4 W aufweist, ohne daß eine Änderung der Versuchsdurchführung vorgenommen wurde.
Die zu messende Energiezufuhr in das System durch den Heizwiderstand liegt zwischen 0 …2,6 W und liegt damit unter der Rauschgrenze und kann damit nicht eindeutig bestimmt werden.
Im Versuch Pkt. 7.4.6. konnte die Schwankungsbreite des Signals über einen Zeitraum von 1,5 Stunden auf 1,6 W gesenkt werden. Die Standardabweichung dieser Messung kann wie folgt berechnet werden:
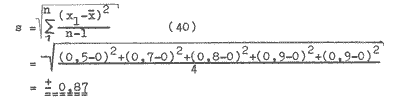
Bei dieser Berechnung wurde die Verringerung des Energieentzuges mit der Annäherung beider thermodynamischer Systeme (Fermentorinhalt und Arbeitsraum) berücksichtigt. Bei den aufgetragenen Signalpunkten besteht ein linearer Zusammenhang, der stark gestört ist. Die Beobachtbarkeit ist für den Meßbereich von 1 W nicht gegeben, weil aus der im Zeitpunkt t0 ermittelten Ausgangsgröße nicht auf künftige Meßwerte geschlußfolgert werden kann, da die Schwingungsbreite der Amplitude über der zu messenden Größe liegt. Damit ist eine Rekonstruierbarkeit der Messung in einem Bereich von 1 … 2 W nicht möglich.
Die wesentlichen Störgrößen, die den Meßprozeß beeinflussen, konnten erkannt werden. Diese lokalen und inneren Störgrößen sind ausregelbar. Durch geringfügige technische Veränderungen können diese Störeinflüsse verringert werden, so daß der Schwankungsbereich der Amplitude des Meßsignals auf < 1 W gesenkt werden kann. Diese Behauptung soll im nachfolgenden Punkt anhand der erhaltenen Meßwerte (Bild 7) dargestellt werden.
Eine Änderung der Wärmeentwicklung durch die Mikroorganismen erfolgt im kontinuierlichen Fermentationsprozeß gleichmäßig und wird durch die Entwicklungskinetik der Kultur und ihrer Konzentration bestimmt. Bei einer unvorhergesehenen Abweichung von den Prozeßparametern, wie z. B. Temperatur- oder pH-Wertänderung, Substratmangel oder anderem, tritt eine Niveauänderung des aufgezeichneten Signals infolge veränderter Wärmeproduktion durch die Mikroorganismen auf. Dies wird als Beispiel im Bild 10 dargestellt.
Bild 10: Signalverlauf bei Niveauänderung der Bildungswärme
Für die weitere Betrachtung des Meßprozesses wird von der Annahme ausgegangen, daß die Störgröße der Meßungenauigkeit von ± 0,1 K der Temperatur des Fermentorinhaltes auf ± 0,01 K verringert ist. Die zusätzliche Wärmeaufnahme des Kühlwassers durch den Antriebsmotor (Strahlung) ist gleichmäßig und soll vernachlässigt werden, ebenfalls wird auf eine Verdrehung der Abszissenachse, wie es im Pkt. 7.4.6. durchgeführt wurde, verzichtet. Es erfolgt lediglich eine Verschiebung des Nullpunktes auf der Ordinatenachse, um die Veranschaulichung des Signalverlaufes zu verbessern.
Unter dieser Voraussetzung werden nachfolgend einige Teilabschnitte des Bildes 7 gesondert betrachtet.
In der Tabelle 5 sind Meßwerte aus der Tabelle 3 und den handschriftlichen Versuchsaufzeichnungen aufgeführt. Im Bild 11 sind die eingetragene Leistung durch den Heizwiderstand und die dazugehörige experimentell (hier ist die o.g. Einschränkung zu beachten) aufgenommene Kennlinie dargestellt. Die Wertepaare sind in die jeweiligen Koordinatensysteme eingetragen. Da die Meßwerte Fehler bedingt stark streuen ist der zeichnerische Verlauf der Kennlinie nur schlecht darstellbar. Es wurden daher der log QS als Funktion von 1/T grafisch dargestellt. Durch die so erhaltene Gerade konnten zusätzliche Meßpunkte für den Kurvenverlauf gewonnen werden. Diese zusätzliche Auswertung wurde wegen ihrem Umfang nicht in diese Arbeit aufgenommen. Bei der sprunghaften Änderung der Wärmezuführung um den Betrag von 1,7 W erfolgt eine Änderung von Q0 auf Q1 bei der aufgenommenen Kennlinie zwischen 1,7 bis 2,3 W. Dies ist eine Abweichung von 0 bis 35% vom Sollwert. Erfolgt umgekehrt eine sprunghafte Änderung, so ist die Abweichung vom Sollwert zwischen 0 bis 129%. Die Ursache für die große Abweichung dürfte darin begründet sein, daß das Schutzrohr mit dem Widerstand aus der Flüssigkeit herausgenommen wurde. Bei dem Bild 11.7 wurde nur die Spannungsquelle abgeschalten und die Abweichung beträgt 0% vom Sollwert.
Der Funktionsverlauf der Signale in den Koordinatensystemen ist wegen der Störgrößenbeeinflussung und der Durchführungsart der Versuche unterschiedlich. Eine Betrachtung und Auswertung des dynamischen und statischen Verhaltens kann nicht durchgeführt werden.
Bild 11: Signalverlauf bei einer sprungförmigen Änderung des Wärmestroms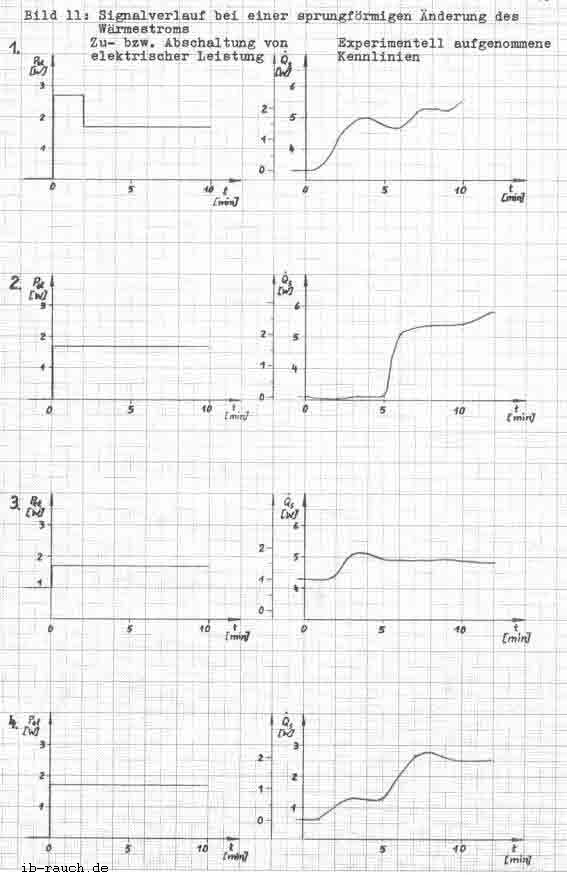
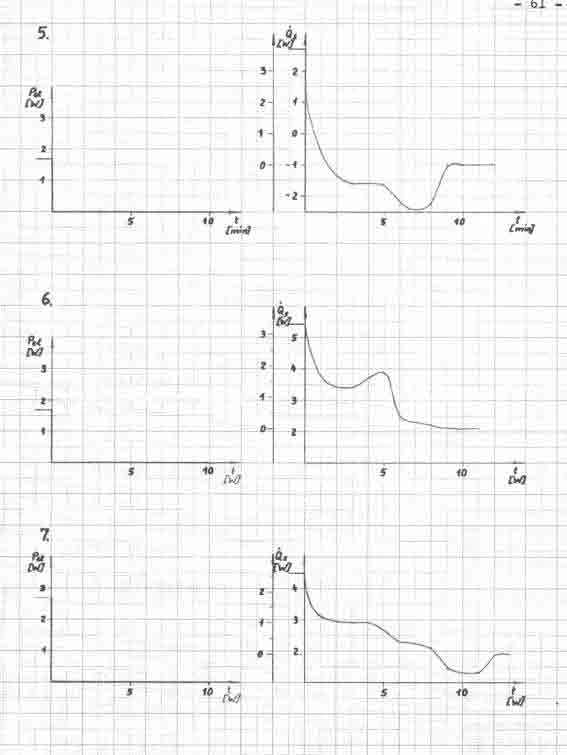
Um die in der Aufgabenstellung festgelegte Forderung, Auswahl einer geeigneten Methode zur Messung der Wärmetönung durch Mikroorganismen, durchführen zu können, war eine umfangreiche Betrachtung der theoretischen Grundlagen zur Kalorimetrie erforderlich. Ebenfalls mußte sich mit der Bildungswärme, der Fermentation und der Eigenschaften der Hefekultur Saccharomyces c. beschäftigt werden. Die in der Literatur aufgeführten Meßverfahren zur direkten Messung der Wärmeentwicklung im mikrobiellen Stoffwechsel wurden bewertet. Es mußte jedoch festgestellt werden, daß diese Methoden vorwiegend nur im Labormaßstab anwendbar sind. Hier treten noch die Schwierigkeiten auf, daß aerobe Proben nur bedingt gemessen werden können. Günstig ist die kontinuierliche Kalorimetrie, da hier die Probe im Reaktionsbehälter verbleibt. Durch den kontinuierlichen Kühlwasserfluß und die elektrische Eintauchheizung ist diese Methode nicht auf eine Großanlage übertragbar. Es wurden daher eigene Gedanken entwickelt, die von der Forderung ausgehen
Die Methode geht davon aus, daß der produzierte Wärmefluß durch das Kühlwasser aufgenommen wird. Durch die Bildung der Temperaturdifferenz des Kühlwasserzu- und -ablaufes sowie der Durchflußmenge kann der Wärmestrom bestimmt werden. Strömt kein Kühlwasser, z. B. Unterschreitung der Solltemperatur, so wird die Wärme des Fermentorinhaltes in einem festgelegten Zeitabstand bestimmt. Aus der Änderung kann der Wärmestrom bestimmt werden. Bei diesem Meßverfahren ist eine geringe Abweichung vom Istwert zulässig, da zu der Aussage über die Änderung des physiologischen Zustandes der Kultur kein absoluter Meßwert notwendig ist. Es reicht somit aus, wenn äußere Störgrößen, wie Temperaturänderung des Arbeitsraumes, einmal erfaßt, durch ein entsprechendes Programm im Prozeßrechner bei der Berechnung und Aufzeichnung des Signals berücksichtigt werden. Auf dieser Grundlage erfolgte die Versuchsdurchführung.
Im Punkt 2.4. wurde auch der Gedanke entwickelt, eine direkte Messung der Wärmeentwicklung mit einem Meßfühler. Die Zellen werden mit einem schwachen Magnetfeld umgeben, mit dessen Hilfe sie sich orientieren, z. B. in welche Richtung die Zelle wachsen kann. Die Intensität des Magnetfeldes ist je nach Größe und Art der Zelle unterschiedlich. Dieses Magnetfeld läßt sich gut mit einem entsprechenden Meßfühler bestimmen. Die Methode wird in HOPPE /46/ beschrieben. Inwieweit dies bei Hefezellen und Bakterien anwendbar ist, kann nicht beantwortet werden.
Die vorgesehene automatische Meßwerterfassung konnte in der zur Verfügung stehenden Zeit nicht technisch realisiert werden. Mit der Testung der Meßeinrichtung konnte die Funktionstüchtigkeit nachgewiesen werden. Allerdings treten viele Störgrößen auf, die vor allem technische Ursachen haben z. B.:
Unter den gegebenen Bedingungen wurde ein stochastisches Analogsignal aufgezeichnet. Definierte Wärmezuführungen von 1 … 2,6 W werden mit einer Schwankungsbreite bis 8,4 W angezeigt. Durch einen Teilversuch wurden kurzzeitig (90 Minuten) annähernd konst. Bedingungen geschaffen, so daß eine Schwankungsbreite von 1,6 W mit einer Standartabweichung von ± 0,87 erreicht werden konnte. Auf Grund der wirkenden Störgrößen, die sich in der zur Verfügung stehenden Zeit nicht abstellen ließen, wurde auf die Testung der Meßeinrichtung mit der Hefekultur verzichtet.
In einer anschließenden Betrachtung wurde der Versuch unternommen, die wesentliche Störgröße (Meßgenauigkeit der Fermentortemperatur) durch Glättung der gemessenen Temperaturdifferenz der Fermentorflüssigkeit, die in der Zeit t0 bis t1 auftritt, zu verkleinern. Es wurde somit möglich den Signalverlauf grafisch besser darzustellen. Bei einer sprunghaften Änderung der Wärmezuführung konnte eine Kennlinie dargestellt werden. Die Abweichung von der eingetragenen Leistung von 1,7 W liegt zwischen 0 und l20%.
Wird die Wärmeproduktion der Kultur Saccharomyces c. betrachtet, so liegt sie bei einer Bildung von 1 gHTS/l und 5 l Fermentorinhalt bei 23,6 W. Die festgestellte Schwankungsbreite der Amplitude des Signals mit 8,4 W beträgt rund 30% der zu messenden Größe. Das erreichte Meßsignal ist wegen der Schwankungsbreite für eine Messung der o.g. Wärmeproduktion wenig geeignet. Bei sorgfältiger Meßdurchführung unter den gegebenen technischen Bedingungen könnte mit dem erreichten Ergebnis aus dem Pkt. 7.4.6. eine Fehlerabweichung von nur 8% liefern.
Zum Vergleich sollen zwei Zahlen genannt werden, mit welchen Energieströmen in der Praxis gearbeitet wird. Aus einem 300m3 Bioreaktor müssen 4,4 x l06kcal/h abgeführt (/39/ S.276) und aus einer 38 m3 Molkenverhefungsanlage muß die spezifische Reaktionswärme von 1,6 MJ/kg HTS durch 13 m3 Kühlwasser stündlich abgeführt werden (/55/ S. 27).
Als Schlußfolgerung zu der Versuchsdurchführung kann festgestellt werden:
| /1/ | Direktive des XI. Parteitages der SED zum Fünfjahrplan für die Entwicklung der Volkswirtschaft der DDR in den Jahren 1986 bis 1990, Dietz Verlag Berlin 1986 |
| /2/ | Kula, Maria-Regina: Enzyme in: Handbuch der Biotechnologie Bd. III von Präve, P., Faust, U.: Akademische Verlagsgesellschaft Wiesbaden 1982 |
| /3/ | Meyer, G., Schiffner, E.: Übungen zur Technischen Thermodynamik, VEB Fachbuchverlag Leipzig 1986 |
| /4/ | Schuller, D.: Thermodynamik, 1. Vieweg Verlag Braunschweig 1973 47-69 |
| /5/ | Vodrázka, Z.: Physikalische Chemie für Biologen, Mediziner, Pharmazeuten, VEB Verlag Volk und Gesundheit Berlin 1979 |
| /6/ | Näser, K. H.: Physikalisch chem. Rechenaufgaben, VEB Deutscher Verlag für Grundstoffindustrie Leipzig 1963 |
| /7/ | Meyer, G., Schiffner, E.: Technische Thermodynamik, VEB Fachbuchverlag Leipzig 1983 |
| /8/ | Job, G.: Neudarstellung der Wärmelehre, Akad. Verlagsgesellschaft Frankfurt/M. 1972 85-93 |
| /9/ | Lamprecht, I.: Mikrokalorimetrische Untersuchungen an Hefekulturen, Diss., Freie Univ. Berlin 1969 1-5 |
| /10/ | Bockhardt, H. D., Güntzschel, P., Poetschukat, A.: Grundlagen der Verfahrenstechnik für Ingenieure, VEB Deutscher Verlag für Grundstoffindustrie Leipzig 1981 |
| /11/ | Autorenkollektiv: Leitfaden der Physik, VEB Fachbuchverlag Leipzig 1980 |
| /12/ | Bergmann, H., Trieglaff, K.: Physikalische Chemie - Wissenspeicher, VEB Deutscher Verlag für Grundstoffindustrie Leipzig 1975 |
| /13/ | Ullmann, : Enzyklopädie der technischen Chemie Band 5, Verlag Chemie Weinheim•Deerfield - Beach, Florida•Basel 1980 |
| /14/ | Witte, E.: Entwicklung und Anwendung quantitativer Methoden der „Thermischen Analysen“ und Mikrokalorimetrie zur Ermittlung thermodynamischer und kinetischer Reaktionsparameter 1979, Diss. B, Greifswald |
| /15/ | Battley, E.H.: Physiol. Plantaruni 13 674 (1960) |
| /16/ | Carlyle, R.E.; Normen, LG.: J. Bacteriology 41, 699 (1941) |
| /17/ | Forrest,W.W.: J. Sci. Instr. 38, 143 (1961) |
| /18/ | Luong. J.H.T., Volesky. B.; Heat Evolution During the Microb. Processbestimation, Measurement,8.fld App., Canada 1984(?) |
| /19/ | Skinner, H.A. et al.: In: Experimental Thermochemistry ed. Skinner, R.&. p. 157, New York: Wiley 1962 |
| /20/ | Forrest, W.W.: Methods Microbiol. 6 B, 285 (1972) |
| /21/ | Calvet, E.: In: Experimental Thermochemistry (ed.) Skinner, H.A., p. 385, New York, Wiley 1962 |
| /22/ | Calvet, E.: In: Recent Prozess in Microcalorimetry (ed.) Skinner, H.A. p. 1, London: Pergaxnon Press 1963 |
| /23/ | Benzinger, T.H., Kitzinger,C.: Temperature - Its Measureinent and Control in Science and Industry, p. 43, New York: Reinhold 1963 |
| /24/ | Benzinger, T.H.: Fractions 2,1 (1965) |
| /25/ | Eriksson, R., Wadsö, I.: Proc. Ist Eur. Biophys. Congr. 4. 319 Wien Med. Akad. (1971) |
| /26/ | Erkiksson, R. Holme, T.: Biotech. Bioeng. Symp. 4, 581 (1973) |
| /27/ | Cooney, C.L. et al.: Biotech. Bioeng. 11, 269 (1969) |
| /28/ | Luong, J.H.T., Volesky, B.: J. Europ. App. Microbiol. Bio- techn. 16, 28 (1982) |
| /29/ | Sayyadi, Parviz: Mikrokalorimetrische Untersuchungen an synchronen Kulturen von Saccharomyces cerevisiae, Diss. Freie Univ. Berlin 1978 |
| /30/ | Hoffmann, ; Gatmanda, .: Einführung in die Betriebsmeßtechnik, Verlag Technik Berlin 1973 |
| /31/ | Götte, K. et al.: Taschenbuch Betriebsmeßtechnik, VEB Verlag Technik Berlin 2. Aufl. 1981 |
| /32/ | Scharlipp, M.: Vortrag auf Fachtagung „Temperatur 82“, Suhl, Nov. 1982 |
| /33/ | Bender, H.: Biologie und Biochemie der Mikroorganismen, Chem. Taschenbücher, Verlag Chemie 1970 |
| /34/ | Präve, P., Paus, U.: Handbuch der Biotechnologie, Oldenburg 1984 |
| /35/ | Schild, D.: Mikrorechnergesteuerte Digitalthermometer der Baureihe DTM 2000, rfe Berlin 33 (1984)9, S.566 bis 568 |
| /36/ | Breier, J., Richter, W., et al.: Automatisierungstechnik, Praxis, Aufgaben und Lösung, VEB Verlag Technik Berlin 1980 |
| /37/ | Friedrich, .; Technische Hochschule Leipzig, Sektion Naturwissenschaften 1987 |
| /38/ | Bonfig, K. W.: Techn. Durchflußmessung, Vulkan-Verlag-Essen 1977 |
| /39/ | Wulf, C.: Biotechnologie, LB der angewandten Mikrobiologie, Oldenburg 1984 |
| /40/ | Hesse, J.: Beitrag zur Identifikation und Steuerung von Systemen zur mikrobiellen Stoffwandlung am Beispiel eines rechnergesteuerten Fermentors, Diss. A, Techn. Hochschule Leipzig 1984 |
| /41/ | Versuchsanleitung zum Praktikum Prozeßsteuerung, Fermentor I, Techn. Hochschule Leipzig 1987 |
| /42/ | Rehm, H. J.: Industrielle Mikrobiologie, Springer Verlag 1980 |
| /43/ | Nagai, S.: In: Advances in Biochemical Engineering, Vol 11 (sds.) Ghose, T.K., Fiechter, A., Blakebrongh, H., Berlin: Springer 1979 |
| /44/ | Lewis, C.W.: Energy requirement for single cell proteinproduction, J appl. Chem. Biotechnol. 26. 568 (1976) |
| /45/ | Sukatsch, D. A., und Faust, U.: Berechnung von Ertragskoeffizienten von KW Fermentation S. 197 bis 215, In Rehm,H.J.(ed.) Dechema Monographien 81. Biotechnologie, Verlag Chemie, Weinheim (1977) |
| /46/ | Renger, G.: Biologische Energiekonservierung; In: Biophysik von Hoppe, W. ed al.: Springer Verlag Berlin, Heidelberg, New York 1982 |
| /47/ | Roels, K.: Prog. Ind. Microbiol. 14 95- 203 (1979) |
| /48/ | Nüsse, .: Methoden zur Gewinnung synchroner Hefezellen durch Selektion und ihre Grenzen, Diss., J.W. Goethe Univ. Frankfurt/M. 1973 |
| /49/ | Richter, K., Becker, U.: Effects of Temperature on Microbiol Ethanol Production, Acta, Bioteclmol. 7(1987), 87 bis 92 |
| /50/ | Rogers, P.J., Stewart, P.R.: J. Gen. Microbiol. 79, 205 1973 |
| /51/ | Fiechter, A.: Proc. 4th Int. Symp. Yeasts Wien Part II S. 17 bis 33, 1974 |
| /52/ | Weibel, E.K.: Zur Energetik von Saccharomyces cerevisiae Diss. ETH Zürich 1973 |
| /53/ | Chen, S.L., Gutmania, F.: Biotechnol. Bioeng. 18, 1455 bis 1462 1976 |
| /54/ | Balzer, D.: Automatisierte Steuerung verfahrenstechn. Systeme, Diss. B, Techn. Hochschule Leipzig 1976 |
| /55/ | Rauch,P.: Techn. ökon. Untersuchung im Rahmen der Konzeption einer Molkenverhefungsanlage mit Einsatz von verdünnter Labmolke am Beispiel des Standorte Mügeln, Ingenieurschule für Chemie Magdeburg 1985 |
Berghoff, .: Automatisierung und Prozeßrechner, Deutscher Verlag für Grundstoffindustrie Leipzig 1974
Hofmann, D.: Handbuch Meßtechnik und Qualitätssicherung, VEB Verlag Technik Berlin 1986
Brack, G., Helms, A.: Automatisierungstechnik, VEB Deutscher Verlag für Grundstoffindustrie Leipzig 1985
Hart, II.: Einführung in die Meßtechnik, DB Standnr. T 7505 S. l29 msr 28 1985 S.1/31
Günther, I.: Entwicklung und Bau eines weitgehend automatisierten Zwilling-Kalorimeters mit vielseitigen Anwendungsmöglichkeiten. Diss. B‚ TH Magdeburg 1975
Luise Berthe-Corti: Mikrokalorimetrische Untersuchungen zur Proteinsynthese in zellfreien Systemen aus Hefe, Diss. A, 1975
Jürgen du Puits: Meßwerterfassung an einem Fermentationsprozeß und Automatisierung der Versorgung mikrobieller Kulturen mit Sauerstoff bzw. Kohlenstoff, Diss. A ‚ 1975 HS Leipzig
Schreiter, W.: Chemie, VEB Fachbuchverlag 1986
Pannach, Max: persönliche Mitteilung, CLG HA Biotechnologie 1987
Liebetrau, Lothar: persönliche Mitteilung, CLG HA Biotechnologie 1987
Klaus, .: persönliche Mitteilung, CLG HA Biotechnologie 1987
Evers, .: persönliche Mitteilung, Ingenieurschule für Chemie Magdeburg, 1987
Patent G 01 K 17/12/ Auslegschrift 27 11 4 37 vom 16.3.77
G 01 K 17/12/ Patentschrift 126 422 vom 13.7.77
| Verzeichnis der Schemata | ||
|---|---|---|
| Seite | ||
| 1 | Darstellung der Messung der Wärmetönung in einem Laborfermentor unter adiabatischen Bedingungen | 24 |
| 2 | Messung des Wärmestroms im Fermentor | 26 |
| Verzeichnis der Bilder | ||
|---|---|---|
| Seite | ||
| 1 | Brückenschaltung zur Messung der Temperaturdifferenz | 29 |
| 2 | Brückenschaltung mit 2 Temperaturmeßfühler Pt100 | 30 |
| 3 | Prinzip einer Meßwerterfassung | 33 |
| 4 | Entwicklungskinetik | 37 |
| 5 | Abhängigkeit des Wärmestromes aus dem Fermentor von der Wärme des Fermentorinhaltes | 47 |
| 6 | Meßsignal bei Verwendung eines Widerstandes | 50 |
| 7 | Meßsignal bei Verwendung eines Widerstandes | 53 |
| 8 | Wärmeentzug aus dem System Fermentor | 55 |
| 9 | Prozeßgrößen | 56 |
| 10 | Signalverlauf bei Niveauänderung der Bildungswärme | 58 |
| 11 | Signalverlauf bei einer sprungförmigen Änderung des Wärmestroms | 60 |
| 12 | Eichkurve für Temperaturdifferenz bei Speisespannung 2,7 V/ | 44 |
| Verzeichnis der Tabellen | ||
|---|---|---|
| Seite | ||
| 1 | Messung des Wärmestromes am Fermentor LFS 212 | 71 |
| 2 | Meßwerte zur Erprobung der Meßeinrichtung mit Heizwiderstand | 72 |
| 3 | Meßwerte zur Erprobung der Meßeinrichtung mit Heizwiderstand | 74 |
| 4 | Meßwerte bei der Erprobung eines kontinuierlichen Kühlwasserflusses | 78 |
| 5 | Wertetabelle für die Bestimmung der Sprungantwort | 79 |
| Verzeichnis der Anlagen | ||
|---|---|---|
| Seite | ||
| 1 | Technologisches Schema des Fermentors mit Meß- und Steuerstellen | 82 |
| 2 | Grenzwerte in Ω für Platin (Widerstandswerkstoff) nach TGL 0-43 760 | 83 |
| 3 | Sensoren für Produktions- und Entwicklungsfermentoren | 84 |
| 4 | Temperaturregelung bei Fermentationsbetrieb | 85 |
| 5 | Digitalthermometer DTM 2000 | 86 |
| 6 | Schaltskizze zur Anpassung der Meßgröße (Temperaturdifferenz) durch Analog-Digital-Umsetzer als analoges elektrisches Signal für den Prozeßrechner | 87 |
| 7 | Durchflußmessung mittels Kreuzkorrelation | 88 |
| 8 | Technische Daten des Laborfermentorsystems LFS 212 | 89 |
| 9 | Wachstum von Bäckerhefe in Batch-Kultur in flüssigem Nährmedium | 90 |
| 10 | Mineralische Zusammensetzung für die konstante Fermentation von Saccharomyces cerevisiae | 90 |

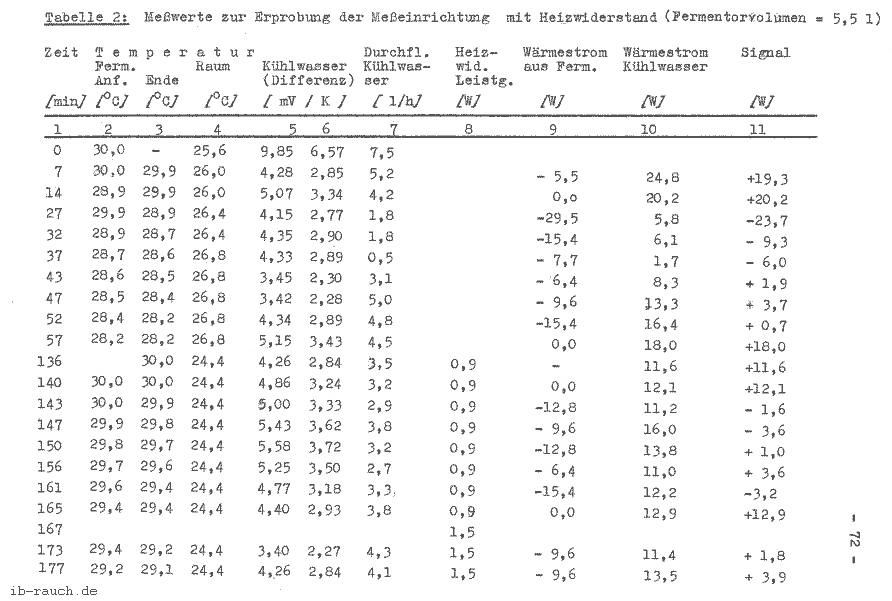
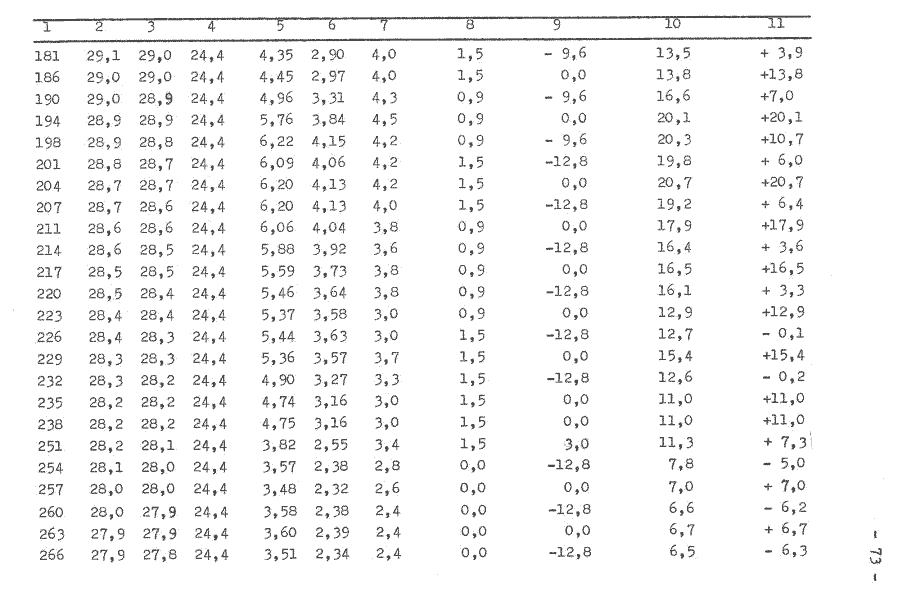
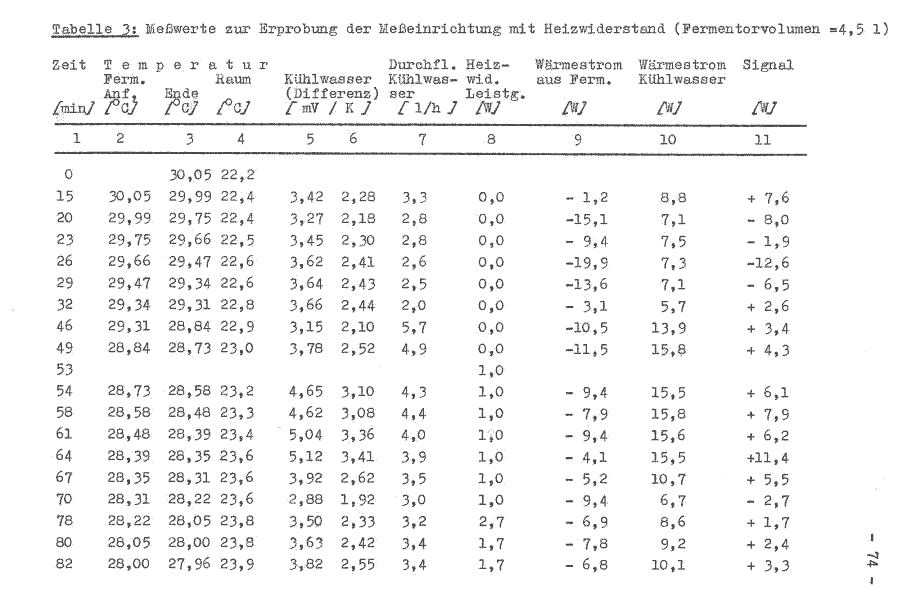
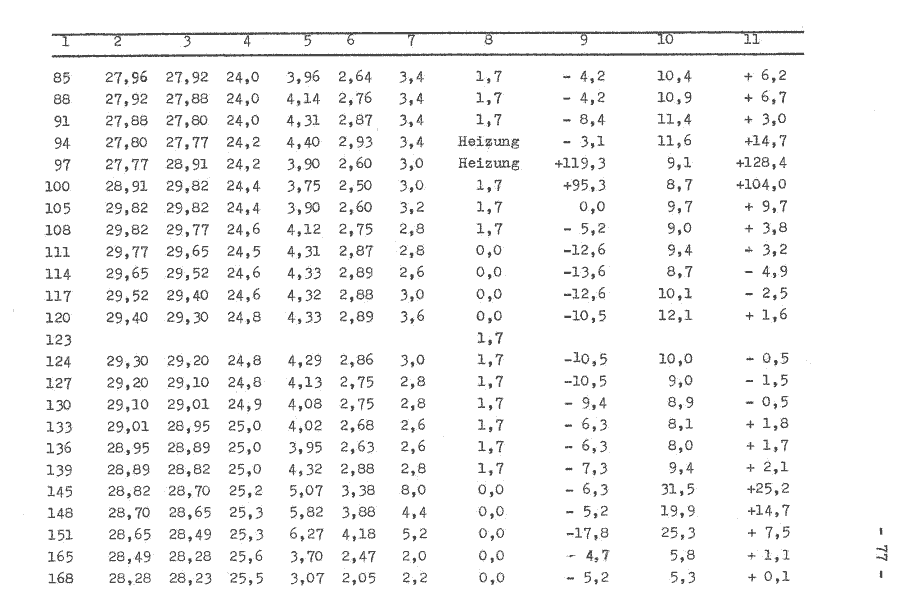
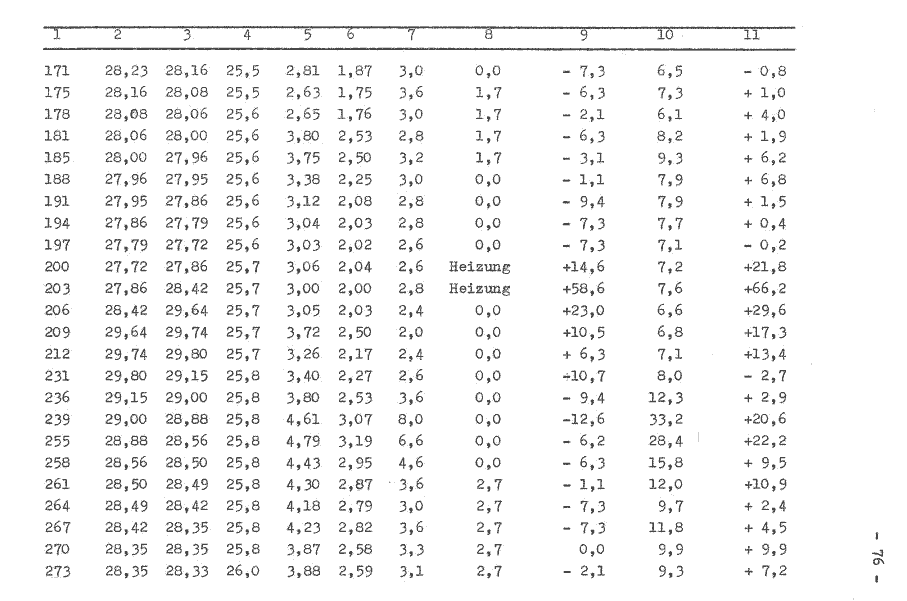
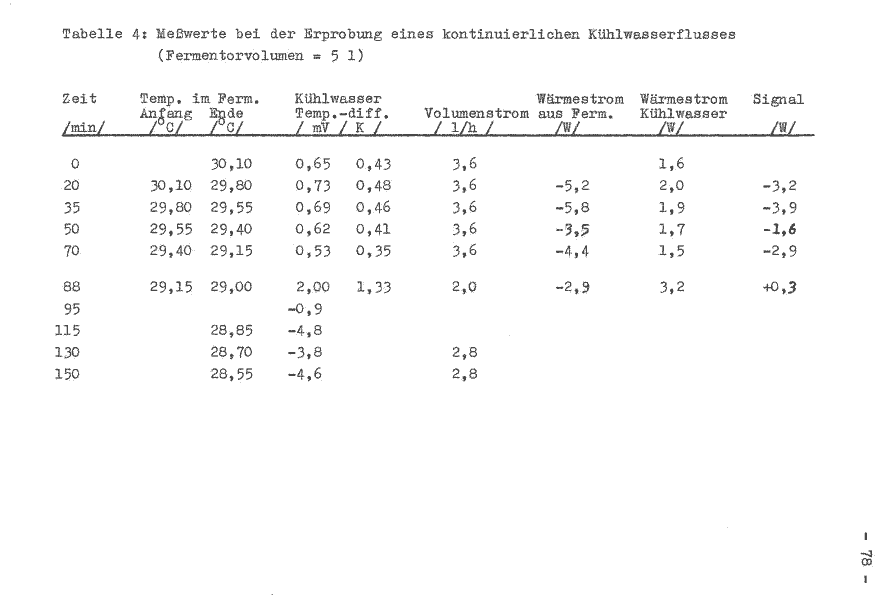
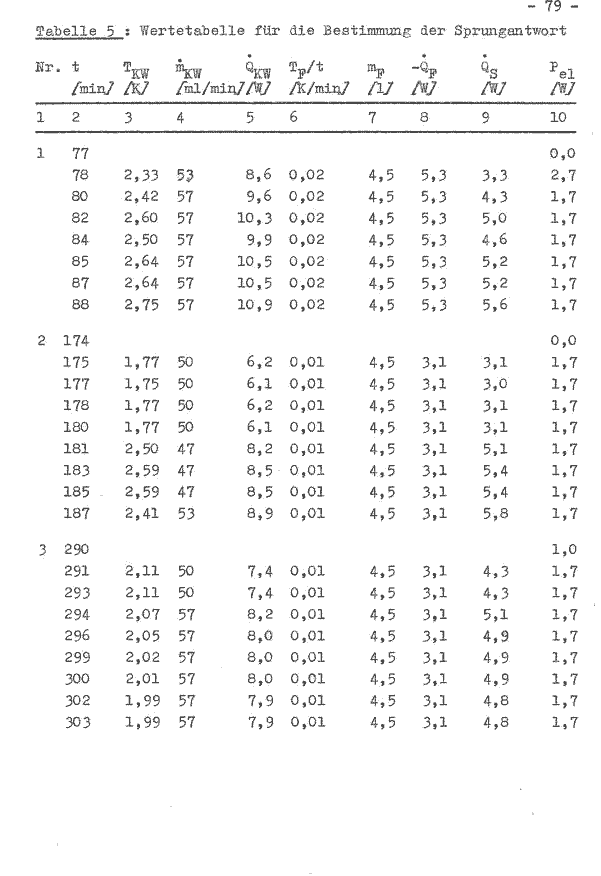
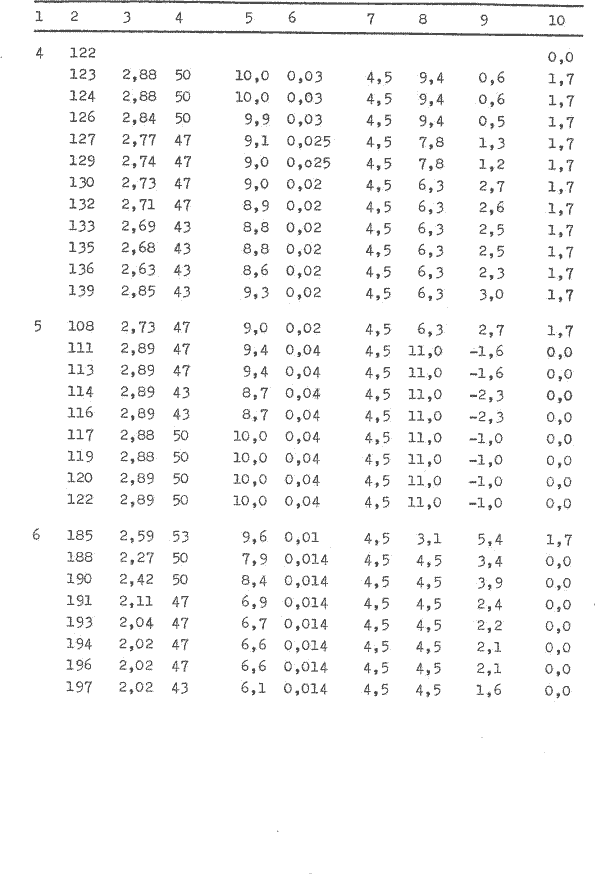
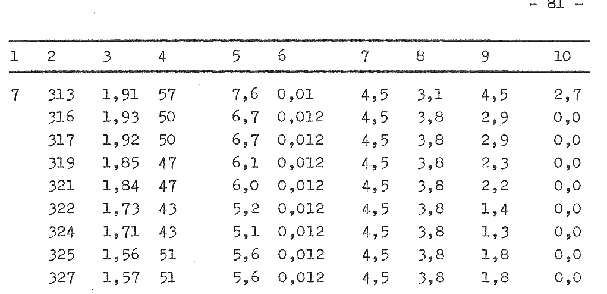
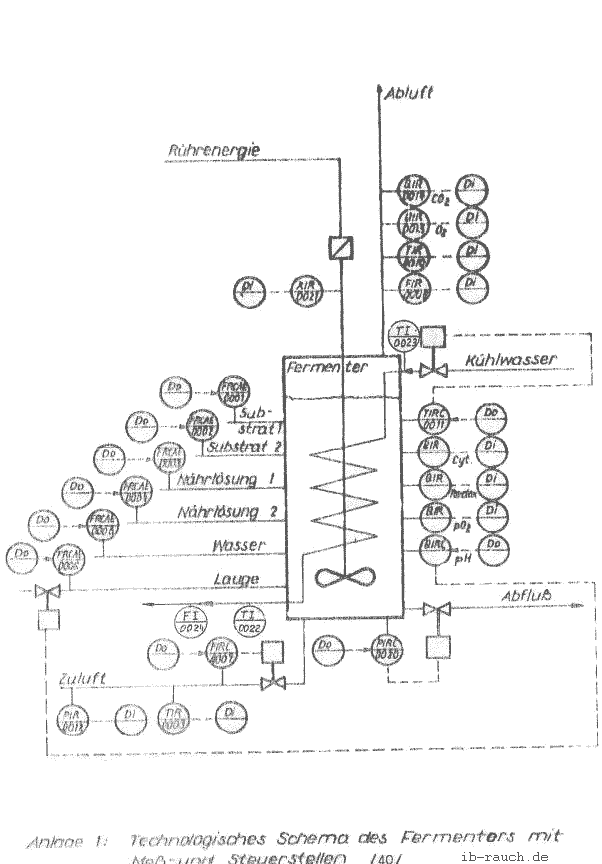


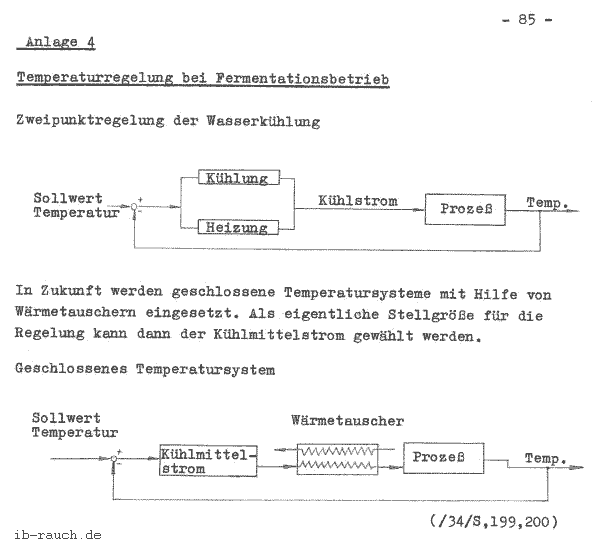
Anlage 5
Digitalthermometer DTM 2000 (/35/ S. 566 ... 568)
Das Digitalthermometer der Baureihe DTM 2000 ist ein universelles Temperaturmeßgerät, an das Fühler dreier Grundtypen angeschlossen werden können. Zur Grundausstattung gehören neben dem Gerät ein Satz Tauchfühler für verschiedene Temperaturmeßbereiche. Anzeigegerät (0,0 °C) Labortischgerät, netzgebunden Meßbereich: - 200 ... + 18000C
Fühlerkennlinie: - Pt100, W100= 1,384 nach TGL 39438
Verarbeitungsfehler: - Pt100 ±0,15 K für t = + 200°C
Integrationszeit einer Messung: 40 ms
Anschluß: Direkt über geeignete Leitung und Steckverbindungen in Dreileiterschaltung, Zuleitungswiderstand je Ader kleiner l0 Ω
Datenausgang: An IMS 2 (IEC-Bus) angeglichen, verkettbar mit Geräten im Listener-on-Betrieb
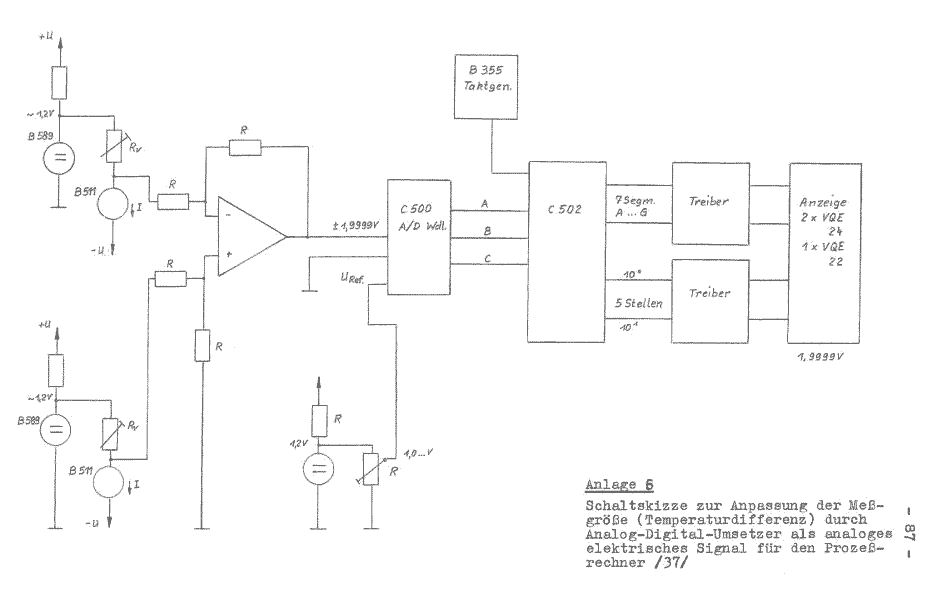
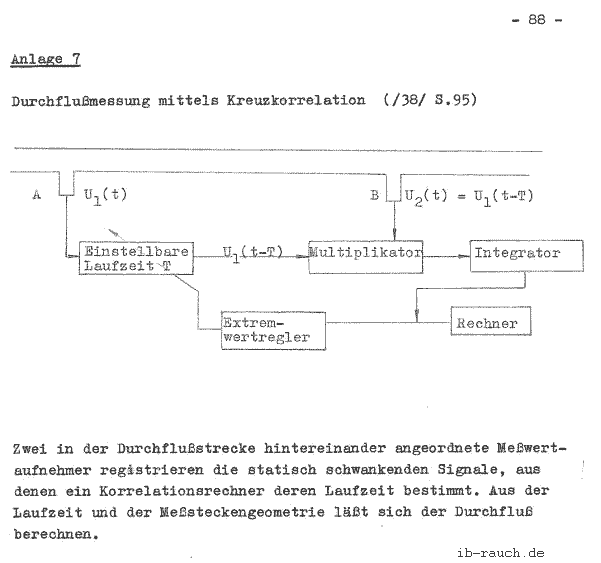


© ib-rauch.de | Inhalt | eBooks | Datenschutzerklärung | 10/2005 ![]()